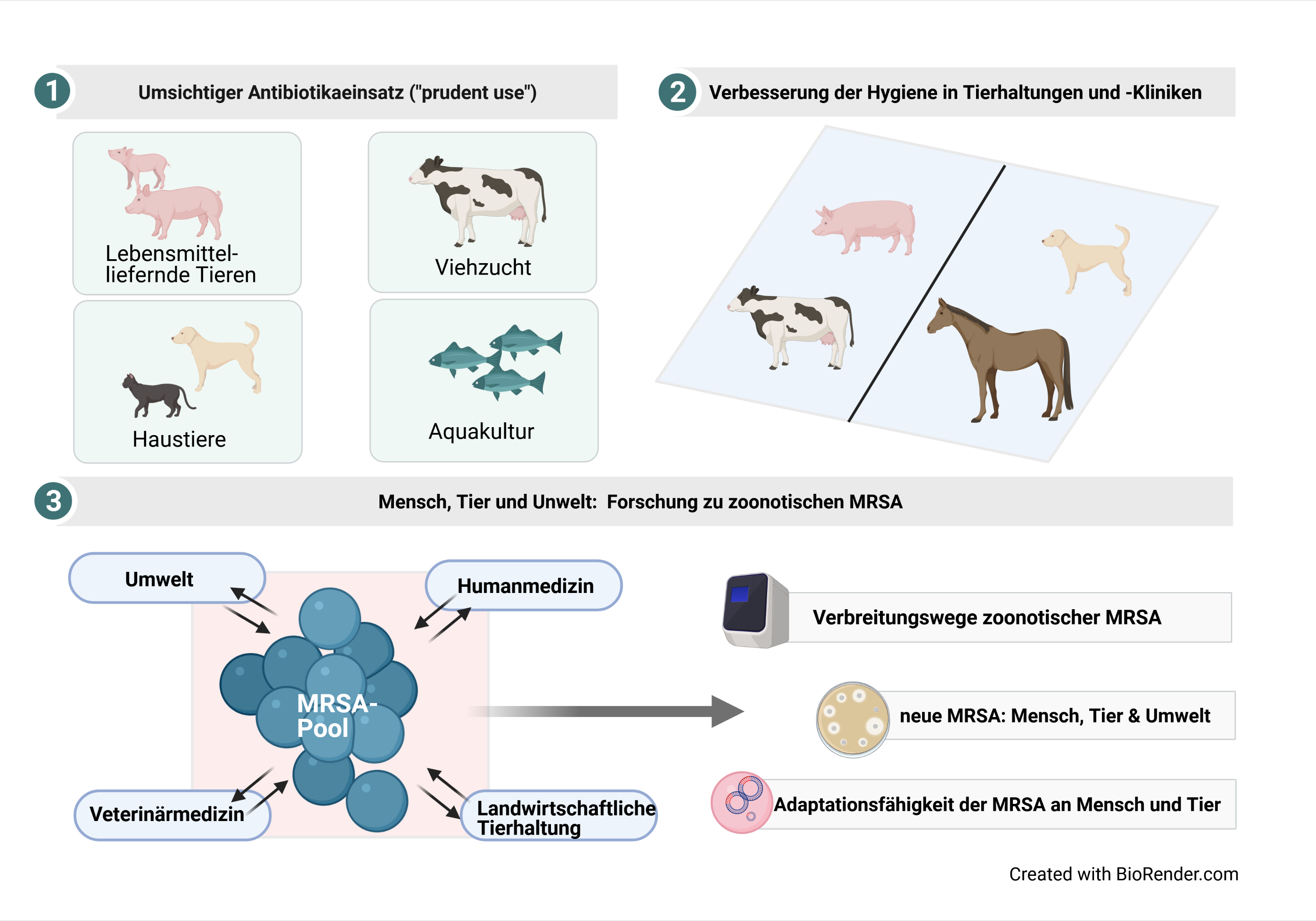
Die Welt der Zoonoseerreger ist vielfältig
Zoonosen sind Erkrankungen, die zwischen Mensch und Tier übertragbar sind. Damit hören die Gemeinsamkeiten jedoch auch schon wieder auf. Näher betrachtet ist die Gruppe der Zoonosen sehr vielfältig. Das beginnt bereits bei der Art des Krankheitserregers, welcher zu den Viren, Bakterien, Pilzen, Parasiten oder Prionen zählen kann. Aber auch die Art der Übertragung – ob direkt, über einen Vektor (wie z. B. Stechmücken oder Zecken) oder über tierische Lebensmittel – kann sehr unterschiedlich aussehen. Weltweit sind mehr als 200 Zoonosen bekannt.
Monatliche Steckbriefe – Zoonosen im Fokus
Mit unserer Rubrik „Zoonose des Monats“ möchten wir Ihnen einen kleinen Einblick in die vielfältige und spannende Zoonosenforschung innerhalb der Nationalen Forschungsplattform für Zoonosen geben. Hierzu stellen wir Ihnen jeden Monat einen Zoonoseerreger in einem gemeinsam mit Experten aus unser Community erstellten „Erregersteckbrief“ vor. Denn auch abseits von Grippe- und Coronaviren gibt es in der Welt viele erwähnenswerte Erreger. Genug um die Rubrik für die nächsten 17 Jahre mit Inhalt füllen zu können. Also viel Spaß beim Lesen!
Juli 2023 - Francisella tularensis
Abb.: Francisella tularensis (48 h, 37°C + 5% CO2) auf MTKH-Agar (Medium T-Kohle-Hämoglobin-Agar). Copyright by Robert-Koch Institut
Beschreibung |
|
|
Francisella tularensis ist der Erreger der Tularämie, u. a. auch als Hasenpest, Lemming- oder Hirschfliegenfieber bekannt. Wie die Namen schon erkennen lassen, handelt es sich bei der Tularämie um eine Zoonose, die unter anderem von erkrankten Tieren auf den Menschen übertragen werden kann. F. tularensis ist ein kleines (0,3 bis 0,7 µm x 0,2 µm), pleomorphes Bakterium ohne Geißeln, welches sich aerob besser mikroaerophil auf Nährmedien kultivieren läßt. Die Bakterien bilden keine Sporen, sind in der Umwelt aber trotzdem sehr widerstandsfähig.
Taxonomisch gehört F. tularensis zur Familie der Francisellaceae in der Ordnung Thiotrichales. Zu der Familie gehören neben der Gattung Francisella (F.) auch die Gattungen Allofrancisella, Cysteiniphilum und Pseudofrancisella sowie die "Francisella-Like-Endosymbionten" (FLE). Zur Gattung Francisella gehört die Art F. tularensis und einige opportunistische Arten wie F. novicida, welche auch als Subspezies von F. tularensis beschrieben wird, sowie F. philomiragia, F. hispaniensis, F. salimarina und weitere, neu entdeckte Arten. Bei F. tularensis werden drei Subspezies (ssp.) unterschieden: F. tularensis ssp. tularensis (Typ A), ssp. holarctica (Typ B) und ssp. mediasiatica, welche sich im geographischen Vorkommen und in der Virulenz unterscheiden. Klinisch relevant und die Tularämie auslösend sind F. tularensis ssp. holarctica und F. tularensis ssp. tularensis. Einige Erreger der Gattung Francisella wie z. B. F. philomiragia kommen in aquatischen Habitaten vor. F. marina, F. noatunensis und F. piscicida sind pathogen für Fische, F. novicida ist pathogen für Mäuse. Diese Arten sind als opportunistische Erreger nur schwach- oder nicht-pathogen für den Menschen und Lösen damit nur bei immunsupprimierten Personen Erkrankungen hervor.
Wie eingehend beschrieben, wird die Tularämie als Zoonose unter anderem von erkrankten Tieren auf den Menschen übertragen. Es können sehr viele verschiedene Tierarten, bekannt sind über 200, an Tularämie erkranken oder Träger von F. tularensis sein. Beim Menschen tritt die Tularämie saisonal gehäuft im Sommer und Frühherbst auf, aber auch im Winter werden viele Fälle gemeldet. Dies liegt unter anderem daran, daß das Vorliegen einer Tularämie-Infektion meist erst nach Ausschluß anderer Infektionskrankheiten differentialdiagnostisch analysiert wird, was zur Verzögerung der Erkennung der Infektion führt. Die Tularämie ist in Deutschland eher eine seltenere Erkrankung mit 60-120 Fällen im Jahr, allerdings liegt die Seroprävalenzrate in Deutschland in der Allgemeinbevölkerung bei 0,2-2,3 %. Studien bei Wildtierpopulationen berichten einen Erregernachweis in 2,4 % der Feldhasen und 3,1 % der Wildschweine. Auch deshalb sollte die Tularämie als Erkrankung bei Mensch und Tier nicht unterschätzt werden. Sie läßt sich sehr gut antibiotisch behandeln.
|
|
Erstmals entdeckt |
|
|
Die Tularämie wurde erstmalig 1911 in Tulare County, Kalifornien von McCoy als eine Pest-ähnliche Erkrankung bei Nagetieren beschrieben. In 1912 gelang ihm zusammen mit Charles W. Chapin die Isolierung des Erregers aus einer Eichhörnchenart. Sie benannten den Erreger „Bacterium tularense“ nach Tulare County, Kalifornien, dem Ort ihrer Studie. In 1947 wurde das Bakterium in "Francisella tularensis" umbenannt, nach Edward Francis, der lange über den Tularämieerreger forschte und auch als erster die Erkrankung der "Tularämie" beim Menschen beschrieb.
|
|
Wo kommt der Erreger vor? |
|
|
F. tularensis ssp. tularensis (Typ A) kommt nur in Nordamerika vor. Man unterscheidet hier noch den hochpathogenen Typ A1 von dem weniger pathogenen Typ A2. F. tularensis ssp. holarctica, beschrieben als Typ B Stamm, hingegen findet man in der gesamten nördlichen Hemisphäre, einschließlich Nordamerika, Europa und Asien. Anhand Genomanalysen des Erregers wird F. tularensis noch weiter in Kladen unterschieden. Die Typ B Stämme von F. tularensis ssp. holarctica unterteilen sich in vier basale Kladen: Klade B.4, hauptsächlich in Nordamerika und Skandinavien vorkommend; B.6, hauptsächlich in West-Europa und Nordamerika vorkommend; B.12, hauptsächlich in Ost- und Zentral-Europa, sowie in Asien vorkommend und B.16 in Japan, aber auch in der Türkei und China vorkommend. In letzter Zeit wurden aber auch Fälle von Tularämie in Iran, Algerien, Kenia und im Sudan beschrieben, deren Zuordnung zu den Kladen noch nicht bekannt ist. In Deutschland wird fast ausschließlich F. tularensis ssp. holarctica Stämme in an Tularämie erkrankten Tieren und Menschen der Kladen B.6 (Biovar 1, Erythromycin-sensitiv) und B.12 (Biovar 2, Erythromycin-resistent) zugeordnet, nachgewiesen. Einzelfälle von Erkrankungen durch opportunistische Francisella-Arten, z.B. F. hispaniensis (Australien, Spanien), F. salimarina (Spanien, Frankreich), F. philomiragia (Nordsee, Norwegen) wurden publiziert. Hier hingegen ist aber nur wenig über ihre Verbreitung bekannt. Tularämie-Ausbrüche kamen bisher u.a. in Spanien, dem Kosovo, Frankreich, der Türkei, Deutschland und auch immer wieder in Skandinavien und Nordamerika vor. Eine Übersicht über die Europaweiten Tularämiefälle kann über die Internetseite der ECDC abgerufen werden.
|
|
Betroffene Tierspezies, Reservoir |
|
|
F. tularensis ist ein Erreger mit extrem breiten Wirtsspektrum. Er infiziert vor allem verschiedene Nagetiere (Mäuse, Wühlmäuse, Ratten) und hasenartige Tiere (Feldhase, Kaninchen), aber auch Wildwiederkäuer, Fleischfresser und sogar Vögel können infiziert werden. Der Feldhase (Lepus europaeus) gilt als Hauptquelle der Übertragung der Tularämie auf den Menschen in Mitteleuropa. In Deutschland sind Mitglieder der Familie Leporidae (Hasen, Kaninchen) ebenfalls wichtige Infektionsquellen und mögliche Reservoire. Mögliche weitere Träger des Erregers sind Füchse, Marderhunde, Wildschweine und auch Biber. Kürzlich wurde erstmalig in Deutschland ein Fall humaner Tularämie nach einem Eichhörnchenbiss beschrieben. Als wichtige Vektoren und damit Überträger, auch auf den Menschen, sind in Deutschland mehrere blutsaugende Arthropoden, darunter Zecken, insbesondere die Auwaldzecke (Dermacentor reticulatus), aber auch der gemeine Holzbock (Ixodes ricinus), Stechfliegen und Mücken bekannt.
|
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
|
Bei der Tularämie handelt es sich um eine zoonotische Erkrankung, also einer Erkrankung die hauptsächlich über infizierte Tiere (direkter Kontakt, Blut, Biss, Ausscheidungen), aber auch durch infizierte, blutsaugende Vektoren (Stechfliegen, Zecken, Mücken, Bremsen) übertragen wird. Zu einer Übertragung auf den Menschen kann es aber auch über den Verzehr kontaminierten Trinkwassers, infizierter Tiere bzw. Tiermaterialien oder anderer kontaminierter Lebensmittel, sowie durch das Einatmen infektiöser Aerosole (z.B. Stäube von Exkrementen infizierter Tiere) kommen. Eine Mensch-zu-Mensch Übertragung ist bisher nicht bekannt. In Deutschland gemeldete Fälle basieren häufig auf den direkten Kontakt mit infizierten Tieren, insbesondere bei Risikogruppen, wie Jäger oder Waldarbeiter. Unter anderem erfolgt eine Infektion durch direkten Kontakt der Haut oder Schleimhäute mit infektiösem Tiermaterial (z. B. bei der Verarbeitung infizierter Tiere); in der Folge auch durch Schmierinfektionen, z. B. Infektion der Augen durch Kontakt mit kontaminierten Händen. Aber auch die Übertragung durch Zecken in Verbindung mit Freizeitaktivitäten im Garten oder in Naturgebieten kommt häufig vor. Die glanduläre und ulzeroglanduläre Form stehen hier im Vordergrund, es werden aber auch pulmonale Erkrankungen registriert (siehe Krankheitssymptome). Der genaue Übertragungszyklus von F. tularensis ist aufgrund des seltenen Auftretens natürlicher Infektionen bzw. Ausbrüchen beim Menschen nicht gut charakterisiert. Deshalb sind Umweltfaktoren, die z.B. die Aufrechterhaltung von Tularämie-Herden fördern, weitgehend unbekannt. Insbesondere die Erregerreservoire in aquatischen Habitaten sind noch immer ungenügend erforscht.
Personen, die folgende Tätigkeiten ausüben, gehören zu einer Risikogruppe: Jäger, Fleischer (Tätigkeiten mit Kontakt zu infizierten Wildtieren), Waldarbeiter, Gärtner (Aktivitäten in der Natur) oder Personen, die kontaminierten Staub einatmen, oder unzureichend erhitztes Fleisch von infizierten Wildtieren verzehren. Mit dem Erreger kontaminierte Materialien (Wasser, Tierkadaver, Wildtierfleisch) bleiben bei kalten Temperaturen (Wintermonate, Gefrierschrank) sehr lange infektiös. Aufgrund der hohen Infektiosität besteht auch ein Risiko für Laborinfektionen.
|
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
|
Die Krankheitssymptome können sehr vielfältig sein, und variieren je nach Eintrittspforte. Die Inkubationszeit ist abhängig von der Infektionsdosis und dem Übertragungsweg und beträgt wenige Tage bis 14 Tage, in der Regel 3-5 Tage, selten können aber auch Inkubationszeiten von mehreren Wochen vorkommen. Zu Beginn treten meist unspezifische grippale Beschwerden wie Fieber, Schüttelfrost, Unwohlsein, sowie Kopf- und Gliederschmerzen auf. Im Verlauf der Krankheit folgen weitere spezifischere Symptome wie ein Geschwür an der Eintrittsstelle, eine ausgeprägte Lymphknotenschwellung als Leitsymptom und bei der pulmonalen Form zusätzlich Brustschmerzen. Bei entsprechender Anamnese sollte eine Infektion mit Francisella immer in Betracht gezogen werden. Je nach Ort des Erregereintrittes werden die ulzeroglanduläre Form, die rein glanduläre Form, die okuloglanduläre Form, die pulmonale Form, die oropharyngeale oder auch die typhoide Form der Tularämie unterschieden. Am häufigsten kommen die ulzeroglanduläre und die rein glanduläre Tularämie mit 45 bis 85 % der Fälle vor. Bei der ulzeroglanduläre Tularämie imponiert ein schmerzhafter Ulkus an der Infektionsstelle (z.B. Hautläsion, Tierbiss oder Zeckenstich) mit einer späteren Entzündung bzw. starken Vergrößerung des dazu gehörenden, ableitenden Lymphknotens. Bei verzögertem Behandlungsbeginn kann die Infektionsstelle vereitern und nekrotisierend in Erscheinung treten. Die Bildung eines Exanthems an der umgebenden Haut bzw. die Bildung eines Erysipels ist möglich. Kommt es "nur" zu einem schmerzhaft geschwollenen Lymphknoten und Fieber, spricht man von einer glandulären Tularämie, wobei die Bildung eines Ulkus ausbleibt. Bei der oralen Aufnahme des Erregers (erregerhaltiges Fleisch, Wasser, Saft) kann es zu einer oro-pharyngealen Tularämie kommen, welche durch eine eitrige Halsentzündung, die sich als Stomatitis, Pharyngitis und/oder Tonsillitis präsentiert und Lymphknotenschwellung gekennzeichnet ist. Bei sehr hohen Infektionsdosen können auch gastrointestinale Symptome auftreten. Die okuloglanduläre Form ist eher selten und die Folge einer Infektion der Bindehaut der Augen, gekennzeichnet durch geschwollene und entzündet, eitrigen Augen. Auch hier können regionale Lymphknoten entzündet sein. Nach Aufnahme des Erregers über die Atemwege kann es zu einer pulmonalen Tularämie kommen. Die Lungenentzündung geht mit Luftnot, Fieber und schleimig-eitrigem Auswurf einher. Diese Form kann in eine Sepsis übergehen. Bei der typhoiden Form der Tularämie ist die Eintrittspforte unklar, und es sind meist nur unspezifische, systemische Krankheitszeichen zu beobachten. Während die Letalität der hochvirulenten Unterart F. tularensis ssp. tularensis beim Menschen unbehandelt bis zu 60% betragen kann, verlaufen Infektionen mit der weniger virulenten Unterart F. tularensis ssp. holarctica meist milder und nicht letal. Ein tödlicher Verlauf bei älteren und immunsupprimierten Patienten im Rahmen einer entwickelten Pneumonie oder Sepsis ist aber nicht grundsätzlich auszuschließen.
Krankheitsbild beim Tier: Auch bei Tieren sind milde Formen mit lokaler Lymphknotenschwellung möglich, aber auch schwerwiegende, septikämische Verlaufsformen kommen vor, je nach betroffener Tierart. Häufig sind Milz und Leber der Tiere stark geschwollen und zeigen weiße Foci und granulomatöse Läsionen in den genannten Organen. Insbesondere bei Nagetieren, Hasen und Kaninchen sind seuchenartige Verläufe mit sehr hoher Sterblichkeit bekannt. Die betroffenen Tiere zeigen struppiges Fell, magern ab, haben einen schwankenden Gang und werden apathisch. Sie verlieren auch häufig aufgrund von Entkräftung ihre natürliche Scheu vor dem Menschen. Auch Hunde genauso wie Füchse, Marderhunde und Wildschweine können befallen werden, weisen aber meist eine gute natürliche Resistenz gegen geringe Mengen der Bakterien auf.
|
|
Gibt es Medikamente oder einen Impfstoff? |
|
|
Um einen schweren Krankheitsverlauf und Komplikationen beim Menschen zu vermeiden, ist eine frühzeitige Therapie wichtig. Wirksam gegen F. tularensis sind Fluorchinolone (insbesondere Ciprofloxacin), Aminoglycoside und Tetracycline (Doxycyclin). Penicilline und andere Beta-Lactam-Antibiotika, einschließlich Carbapeneme oder Piperacillin/Tazobactam, sind wirkungslos. Vor Ausschluss von Resistenzen sollte die Behandlung nicht mit Makrolidantibiotika erfolgen. Die Therapieempfehlung des Ständigen Arbeitskreis der Kompetenz- und Behandlungszentren für Krankheiten durch hochpathogene Erreger (STAKOB) kann über die Internetseite des Robert Koch-Instituts abgerufen werden (www.rki.de). Ein in Deutschland zugelassener Impfstoff für den Menschen steht nicht zur Verfügung.
|
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
|
Dem Gesundheitsamt ist gemäß § 7 Abs. 1 IfSG der direkte oder indirekte Nachweis von Francisella tularensis, soweit er auf eine akute Infektion hinweist, namentlich zu melden. Die Meldungen müssen dem Gesundheitsamt spätestens 24 Stunden nach erlangter Kenntnis vorliegen. Die Tularämie bei Tieren ist gemäß der Verordnung über meldepflichtige Tierkrankheiten, dem zuständigen Veterinäramt zu melden. Dabei müssen das Datum, die Tierart, ggf. der betroffene Bestand und der Kreis gemeldet werden.
|
|
Was sind aktuelle Forschungsfragen/-schwerpunkte? |
|
|
Zur Virulenz von Francisellen, besonders über die Pathogenitätsinsel, welche für ein Sekretionssystem kodiert, wird noch Grundlagenforschung betrieben. Weiterhin wird der Pathometabolismus der Francisella-Wirt-Interaktion verstärkt erforscht. Noch immer sind die eigentlichen Reservoire der Erreger nicht eindeutig identifiziert. Tiere oder aquatische Habitate kommen in Frage, aber auch feuchte Böden. Aktuell ist die Biofilmbildung und deren Rolle für das "Langzeit"-Überleben des Erregers in den verschiedenen Habitaten im Fokus. Die Tenazität des Erregers wird auch hinsichtlich der Fragestellung, wie man erregerhaltige Bereiche erfolgreich dekontaminieren kann, untersucht. Da es auch in Deutschland noch keinen zugelassenen Impfstoff gegen die Tularämie gibt, gibt es auch hierzu einige Forschungsaktivitäten.
|
|
Welche Bekämpfungsstrategien gibt es? |
|
|
Überwachung und Meldepflicht, aber auch weitere Untersuchungen sind wichtig, um das Vorkommen des Tularämie-Erregers in Deutschland zu erfassen und den Erreger bekämpfen zu können. Aber auch die Aufklärung der Bürger über die Tularämie und eine gesteigerte Aufmerksamkeit des Öffentlichen Gesundheitsdienstes (niedergelassene Ärzte, Infektiologen, Mitarbeiter*innen in Gesundheitsämter), sowie Veterinärämter und Jäger als auch Wildtierfleischer ist wichtig, zur Vermeidung von Fehldiagnosen und damit verbundener nicht wirksamer Behandlungen (z.B. unwirksame Antibiotika). Zum Schutz vor Übertragung sollten bei Kontakt mit infizierten Tieren Handschuhe und falls möglich eine Atemmaske (FFP3) getragen werden. Fleisch von Wildtieren sollte nur gut durchgegart verzehrt werden. Bei Arbeiten im Labor sind Arbeitsschutzmaßnahmen entsprechend der Vorgaben nach der Technischen Regel für Biologische Arbeitsstoffe (TRBA) 100 für die Schutzstufe 2 bzw. 3 zu beachten. Kontaminiertes Material muss fachgerecht entsorgt werden. Da der Erreger in so vielen verschiedenen Tieren und Habitaten vorkommt, ist es nicht möglich, den Erreger zu eliminieren.
|
|
Wo liegen zukünftige Herausforderungen? |
|
|
Es wird beobachtet, daß der Klimawandel eine Rolle auf die Verbreitung und die Arten von Vektoren (z.B. Zecken) hat. Wir müssen beobachten, welche Effekte das auf die weitere Ausbreitung der Tularämie bei Menschen und Tieren hat und ob dadurch eine erhöhte Infektionsgefahr für den Menschen entsteht. Man sollte auch Antibiotikaresistenzen des Erregers im Auge behalten, auch wenn multiresistente Erreger bisher bei der Tularämie noch kein Problem darstellen.
|
|
Sonstiges |
|
Weiterführende Informationen:https://www.rki.de/DE/Content/Infekt/EpidBull/Merblaetter/Ratgeber_Tularaemie.html
|
Für die fachliche Unterstützung bei der Erstellung der Steckbriefes zu Francisella tularensis danken wir Klaus Heuner, Holger C. Scholz und Daniela Jacob vom Konsiliarloabor für Tularämie am Robert Koch-Institut.
Juni 2023 - Giardia duodenalis
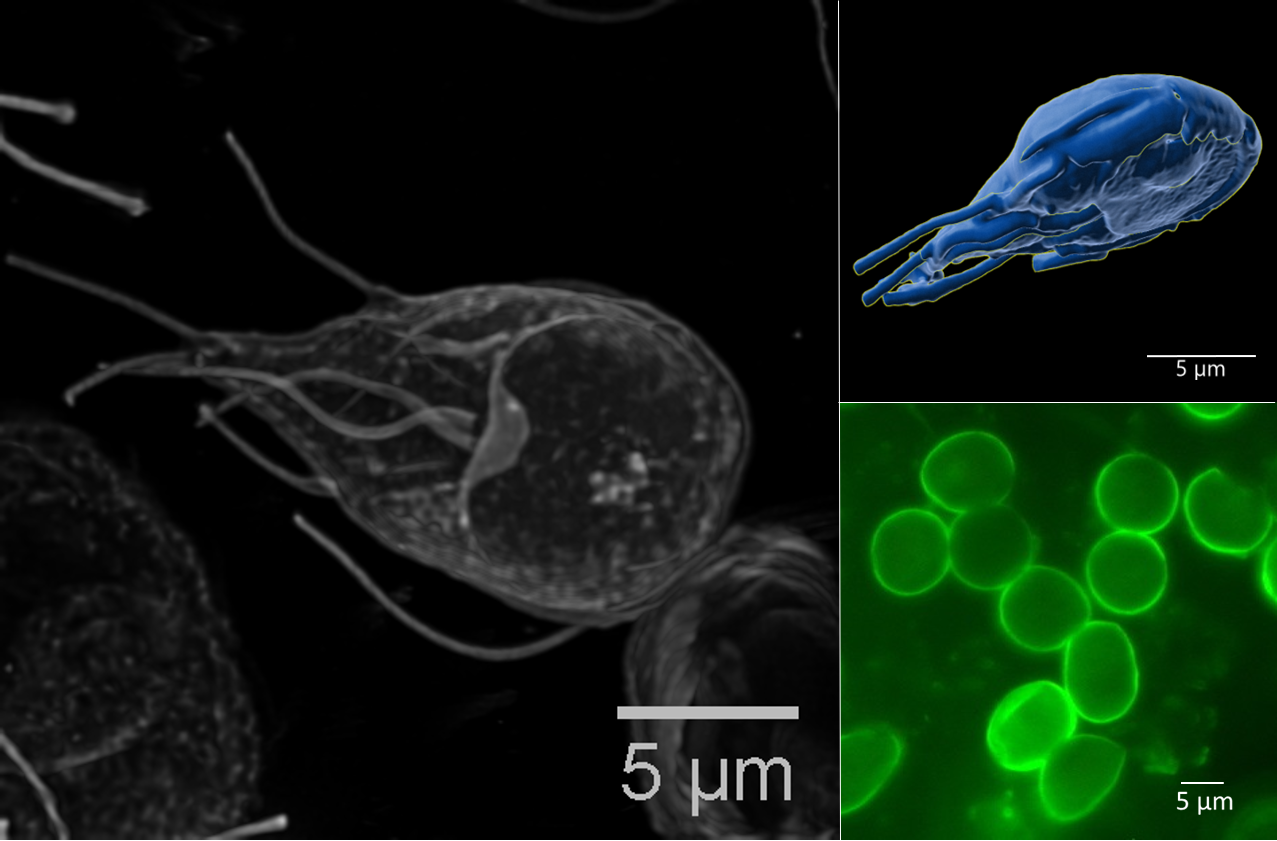
Abb.: Fluoreszenzmikroskopische Aufnahmen von Giardia duodenalis Trophozoiten (links dargestellt mit ventraler Haftscheibe sowie 4 Flagellenpaaren und rechts oben) und ovalen Zysten (rechts unten) der humanpathogenen Assemblage AI. Quelle: C. Weigel und U. Laube (RKI)
Beschreibung |
|
Der einzellige nicht-invasive Parasit Giardia duodenalis, syn. G. intestinalis oder G. lamblia, ist ubiquitär verbreitet und besiedelt im replikativen Trophozoitenstadium den Dünndarm verschiedener Wirtstiere, inklusive des Menschen. Dank seiner einzigartigen ventralen Haftscheibe, kann sich der 9-20 x 5-12 µm große Flagellat an Epithelzellen anheften und somit der Darmperistaltik trotzen. Die Trophozoiten besitzen zwei transkriptionell aktive Nuklei mit asymmetrischer Genexpression sowie 4 Flagellenpaare zur Fortbewegung. Durch Veränderungen in pH-Wert, Gallensalz- und Fettsäurekonzentration entlang des Gastrointestinaltrakts werden Ex- und Enzystierungsprozesse zwischen der replikativen und resistenten Zystform reguliert. Die quadrinukleären ovalen 8-15 x 7-10 µm Zysten können in kaltem Wasser für lange Perioden bis zur fäkal-oralen Aufnahme überdauern. Trotz hoher morphologischer Ähnlichkeit, wird der Spezieskomplex G. duodenalis anhand von Markergenen aus dem rund 12 Mbp großen Genoms in 8 phylogenetische Gruppen (Assemblage A – H) mit variierender Wirtsspezifität unterteilt. Obwohl derzeit erst wenige geeignete Referenzgenome der einzelnen Giardia Assemblagen vorliegen, ermöglicht die Online-Plattform „GiardiaDB“ eine tiefergehende Analyse humanpathogener Stämme der Sub-Assemblagen AI, AII, BIII und BIV. |
Erstmals entdeckt |
|
Im Jahr 1681 wurde der Parasit erstmals vom niederländischen Naturforscher Antonie van Leeuwenhoek bei der Erprobung seiner Mikroskope im eigenen Stuhl beschrieben, welcher die Einzeller als „animalcules“ („kleine Tierchen“) charakterisierte. Der böhmische Arzt Vilém Dušan Lambl zeichnete und beschrieb den Parasiten, zunächst als Cercomonas intestinalis, ausführlicher nach Beobachtungen, die er in Patientenproben machte. In Anerkennung der Beiträge von Lambl und dem französischen Zoologen Alfred Mathieu Giard zur Forschung und Beschreibung des Einzellers wurde im Jahr 1915 der Parasit zu „Giardia lamblia“ von Charles Wardell Stiles umbenannt, der auch eine Zeit in Berlin und Leipzig (bei Rudolf Leukart) studierte. Lange Zeit wurde keine Verbindung zwischen dem Erreger und dem Auftreten gastrointestinaler Symptome gezogen. Erst 1987 wurde Giardia durch das Erfüllen der Koch’schen Postulate als Pathogene identifiziert. Heutzutage ist für den Parasit „Giardia duodenalis“ die weitestgehend akzeptierte Bezeichnung, aber andere Bezeichnungen wie Giardia intestinalis und Giardia lamblia können synonym verwendet werden. |
Wo kommt der Erreger vor? |
|
Als einer der häufigsten intestinalen Parasiten in Menschen, ist Giardia duodenalis verantwortlich für jährlich rund 200 Millionen Giardiasis-Fälle weltweit. Aufgrund von mangelnden Hygienestandards und -prävention, treten Infektionen mit dem Erreger häufiger in Entwicklungsländern (20-30% Prävalenzrate) als in Industrieländern (2-7%) auf. Somit ist Giardiasis in Deutschland mit einem Anteil von 33% (von 1.655 Fällen insgesamt, RKI Stand 2020) eine klassisch reiseassoziierte Erkrankung mit Negativtrend. |
Betroffene Tierspezies, Reservoir |
|
Die acht phylogenetischen Assemblagen von Giardia duodenalis infizieren eine Vielzahl unterschiedlicher Tierspezies. Assemblage A und B infizieren somit nicht nur Menschen, sondern auch eine weite Bandbreite anderer Nutz- und Begleittiere, wie zum Beispiel Hunde, Katzen und Rinder. Die anderen G. duodenalis Assemblagen weisen eine restriktivere Wirtsspezifität auf – während Assemblage C und D hauptsächlich Hunde kolonisieren, sind die Parasiten der Assemblage E zumeist in Huftieren, Assemblage F in Katzen, Assemblage G in Nagetieren und Assemblage H in Seehunden zu finden. |
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Die Übertragung von G. duodenalis erfolgt durch die Aufnahme von infektiösen Zysten über den fäkal-oralen Weg durch direkten (Mensch-Mensch bzw. Mensch-Tier) oder indirekten Kontakt, beispielsweise durch die Aufnahme von mit Zysten verunreinigten Nahrungsmitteln oder Wasser. Nach der Magenpassage exzystiert der Parasit im Duodenum und heftet sich im motilen Trophozoitenstadium an das Dünndarmepithel des Wirts. Als Risikogruppen gelten insbesondere Kinder im Alter bis 3 Jahren sowie immungeschwächte Personen. |
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Während Infektionen mit Giardia duodenalis auch asymptomatisch verlaufen können, ist das Auftreten einer weiten Bandbreite an Symptomen möglich. Typische gastrointestinale Beschwerden wie Magenkrämpfe, Blähungen, Übelkeit, Malabsorption und akute Diarrhö können zu Gewichtsverlust und Dehydrierung führen. Neben der akuten Symptomatik können auch Langzeitfolgen in Form von gastrointestinalen funktionellen Störungen wie chronischer Diarrhö und Reizdarm Syndrom auftreten. Außerhalb des Magen-Darm-Traktes wurde zudem von Beschwerden im Augenbereich, Arthrose oder Allergien berichtet. Bei Kleinkindern kann es aufgrund der Mangelernährung und Dehydrierung zu Entwicklungsverzögerung kommen. |
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt mehrere Antibiotika und Antiparasitika mit denen Giardiasis in Menschen und Tieren behandelt werden kann. Zu den häufigsten verabreichten Präparaten beim Menschen zählen Metronidazol, Tinidazol, Albendazol und Nitazoxanid. Zunehmend wird von therapierefraktären Infektionen berichtet, deren Behandlung mit verschiedenen Kombinationstherapien versucht wird. Kleinere Studien legen nahe, dass refraktäre Infektionen auch mit dem in Deutschland derzeit nicht verfügbaren Quinacrine erfolgreich behandelt werden können. Eine S1 Leitlinie zur Diagnose und Behandlung der Giardiasis soll Ende 2023 verfügbar sein. Experimentell wurden mehrere Impfstoffe an Mäusen, Hunden und Katzen getestet. Für Haustiere wie Hunde und Katzen wurde ein veterinärmedizinischer Totimpfstoff in den USA zugelassen, welcher die Symptome der Infektion vermindern und die Menge an abgegebenen, infektiösen Zysten an die Umwelt reduzieren soll. Die Wirksamkeit des Impfstoffs blieb allerdings unklar, woraufhin die Produktion des Impfstoffs eingestellt wurde. Eine Studie mit einem gentechnisch veränderten Lebendimpfstoff zeigte in Rennmäusen, Hunden und Katzen eine teilprotektive Wirkung gegen eine Belastungsinfektion. Der protektive Wirkmechanismus blieb aber bisher unklar. Impfstoffe für den Menschen sind nicht verfügbar. |
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Giardiasis ist in Deutschland eine Erkrankung mit namentlicher Meldepflicht der diagnostizierenden Labore an die Gesundheitsämter. Im Schnitt der 2000er Jahre wurden 3-4 Fälle gemeldet, davon sind etwa die Hälfte reiseassoziiert. Die Altersverteilung der Fälle ist zweigipflig mit einer ersten Spitze der Inzidenz bei den <5-jährigen und einer zweiten Spitze bei den 25-35 jährigen. Die Ergebnisse von Querschnittsstudien legen nahe, dass nur etwa 1/3 der Infektionen symptomatisch sind und diagnostisch abgeklärt werden und man deswegen von einer starken Untererfassung ausgehen muss. |
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Wichtige offene Forschungsfragen ergeben sich aus den Wissenslücken im Verständnis der Epidemiologie insbesondere dem Anteil zoonotischer vs anthroponotischer Infektionen, der Pathogenese, der Entwicklung effektiverer Medikamente und eines Vakzins. Grundlagenwissenschaftlich stehen Fragen zur Genregulation und Äquivalenz der zwei Kerne und zu einzigartigen zellbiologischen Organellen, wie der Adhäsionsplatte, dieser evolutionsbiologisch sehr weit von Modellorganismen entfernten Diplomonaden im Fokus aktueller Forschung. |
Welche Bekämpfungsstrategien gibt es? |
|
Die Bekämpfungsstrategien setzen primär auf Prävention und medikamentöse Therapie. In Ländern mit hoher Prävalenz als Folge schlechter sanitärer Standards hat die Prävention erste Priorität und ist deswegen der verbesserte Zugang zu sauberem Wasser, zu Sanitäreinrichtungen und Hygienemaßnahmen (WASH) entscheidend, also das Erreichen des 6. Global Sustainable Development Goals und der Ziele der WASH Initiativen. In Ländern mit Zugang zu WASH und niedriger Prävalenz steht die individuelle medikamentöse Behandlung symptomatisch Erkrankter an erster Stelle. Alles in allem stehen deshalb Prävention und Hygiene im Vordergrund, um die Verbreitung des Parasiten zu vermindern. |
Wo liegen zukünftige Herausforderungen? |
|
Wie in vielen Bereichen stellt die Einschätzung der möglichen Auswirkungen des Klimawandels auf die Verbreitung und Häufigkeit von G. duodenalis eine der Herausforderungen dar, vor allem die Frage, wie sich dies auf die Infektiösität der Zysten in der Umwelt auswirkt. Weiter stellt die Tetraploidie eine große Herausforderung dar für den Aufbau einer molekularen Typisierung, um die Epidemiologie dieser Erreger zu verstehen. |
|
Sonstiges |
|
Weiterführende Informationen
Quellen: Adam, R. D. (2001). Biology of Giardia lamblia. Clin Microbiol Rev 14, 447–475. Ankarklev, J., Jerlström-Hultqvist, J., Ringqvist, E., Troell, K. and Svärd, S. G. (2010). Behind the smile: cell biology and disease mechanisms of Giardia species. Nat Rev Microbiol 8, 413–422. Diagnosis and Treatment Information for Medical Professionals | Giardia | Parasites | CDC (2021). European Centre for Disease Prevention and Control. (2022). Giardiasis (lambliasis). In: ECDC. Annual Epidemiological Report for 2019. Stockholm: ECDC. Halliez, M. C. and Buret, A. G. (2013). Extra-intestinal and long term consequences of Giardia duodenalis infections. World J Gastroenterol 19, 8974–8985. Klotz, C., Schmid, M. W., Winter, K., Ignatius, R., Weisz, F., Saghaug, C. S., Langeland, N., Dawson, S., Lalle, M., Hanevik, K., et al. (2023). Highly contiguous genomes of human clinical isolates of Giardia duodenalis reveal assemblage- and sub-assemblage-specific presence–absence variation in protein-coding genes. Microbial Genomics 9, 000963. Mørch, K. and Hanevik, K. (2020). Giardiasis treatment: an update with a focus on refractory disease. Current Opinion in Infectious Diseases 33, 355. Olson, M. E., Ceri, H. and Morck, D. W. (2000). Giardia Vaccination. Parasitology Today 16, 213–217. Pathogen and Environment | Giardia | Parasites | CDC (2021). Prevention and Control | Giardia | Parasites | CDC (2023). Robert Koch-Institut (2019). Falldefinitionen RKI Version 2019. Berlin. Robert Koch-Institut. (2021). Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2020,. Berlin. Sangkanu, S., Paul, A. K., Chuprom, J., Mitsuwan, W., Boonhok, R., De Lourdes Pereira, M., Oliveira, S. M. R., Wilairatana, P., Rahmatullah, M., Wiart, C., et al. (2022). Conserved Candidate Antigens and Nanoparticles to Develop Vaccine against Giardia intestinalis. Vaccines 11, 96. Xu, F., Jex, A. and Svärd, S. G. (2020). A chromosome-scale reference genome for Giardia intestinalis WB. Sci Data 7, 38 |
Für die fachliche Unterstützung bei der Erstellung der Steckbriefes zu Giardia duodenalis danken wir Ricarda Leisering, Antonia Müller, Carlotta Weigel, Ulrike Laube und Dr. Anton Aebischer aus der Abteilung Infektionskrankheiten, Fachgebiet 16: Erreger von Pilz- und Parasiteninfektionen und Mykobakteriosen am Robert Koch-Institut.
Mai 2023 - Kryptosporidien
Abb.: Immunfluoreszenzaufnahme von Kryptosporidien-Oozysten markiert mit Crypt-a-Glo™, Größe der Oozysten ca. 5 µm (Bild: C. Delling)
Beschreibung |
|
Kryptosporidien sind Einzeller, die dem Stamm der Apicomplexa zugeordnet sind. Der Entwicklungszyklus verläuft direkt, ohne den Einbezug eines Zwischenwirts. Nach oraler Aufnahme der Außenstadien, den Oozysten, kommt es zur Freisetzung der sich darin befindlichen Sporozoiten, welche Zellen der Darmschleimhaut befallen. Die Erreger befinden sich nach der Infektion intrazellulär aber extrazytoplasmatisch und entziehen ihrer Wirtszelle über eine Membranstruktur, das so genannte Feeder-Organelle, lebensnotwendige Nährstoffe. Nach i.d.R. zwei durchlaufenden ungeschlechtlichen Vermehrungen (Merogonien), wird eine geschlechtliche Vermehrung (Gamogonie) eingeleitet, aus welcher zwei Typen von neuen Oozysten hervorgehen können. Dickwandige Oozysten werden mit dem Kot an die Umwelt abgegeben, dünnwandige Oozysten können zu einer erneuten Vermehrungsphase durch Autoinfektion im betroffenen Wirt führen. |
Erstmals entdeckt |
|
Die erstmalige Beschreibung erfolgte durch Ernest Edward Tyzzer (1907) in Labormäusen. |
Wo kommt der Erreger vor? |
|
Kryptosporidien sind weltweit ubiquitär vertreten. Der Erreger nimmt v.a. Einfluss auf die Morbidität und die Mortalität assoziiert mit Durchfallerkrankungen bei Kleinkindern aus Low-Income-Countries. In Europa ist er maßgeblich am Durchfallgeschehen von Saugkälbern, seltener beim Menschen, beteiligt. |
Betroffene Tierspezies, Reservoir |
|
Es sind nahezu 40 verschiedene Spezies der Kryptosporidien beschrieben, von denen über 20 Spezies auch als Zoonoseerreger auftreten können. Während einige Kryptosporidienarten ein sehr enges Wirtsspektrum ausweisen, ist der bekannteste und mit Abstand wichtigste zoonotische Vertreter, Cryptosporidium parvum, sehr breit aufgestellt und in der Lage eine Vielzahl von Säugetieren und Vögeln zu infizieren. |
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Die Infektion erfolgt über den fäkal-oralen Weg, im Speziellen durch die Aufnahme der dickwandigen Oozysten aus der Außenwelt. Diese Dauerstadien sind sehr resistent gegenüber Umwelteinflüssen und können unter Umständen über Monate infektiös bleiben. Infektionsquellen stellen kontaminierte Gewässer, kontaminierte Lebensmittel oder der Kontakt zu infizierten Nutztieren dar. Kleinkinder und immunsupprimierte Menschen gelten als Risikogruppen. |
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Aufgrund der Entwicklung des Erregers im Intestinaltrakt kommt es im Rahmen einer Kryptosporidiose zum Auftreten einer häufig wässrigen Diarrhoe, welche u.a. mit Bauchkrämpfen, Fieber und Inappetenz einhergehen kann. Beim Menschen verursachen die Erreger mitunter zusätzlich Übelkeit und Erbrechen. Eine Parasitenansiedlung außerhalb des Darmtraktes ist in immunsupprimierten Menschen bekannt und kann bspw. zu entzündlichen Veränderungen in Gallengängen oder der Bauchspeicheldrüse führen. In Vögeln erfolgen neben intestinalen Infektionen auch Infektionen des Respirationstrakts, dementsprechend zeigen betroffenen Individuen klinische Symptome wie Husten und Atemnot. Des Weiteren können weitere Infektionsgeschehen bspw. in der Bursa fabricii oder den Konjunktiven auftreten. In der Regel handelt es sich bei der intestinalen Kryptosporidose um eine selbst limitierende Erkrankung, die sich allerdings unter bestimmten Umständen wie bspw. einer Schwäche des Immunsystems auch chronisch manifestieren und schlimmstenfalls tödlich enden kann. |
Gibt es Medikamente oder einen Impfstoff? |
|
Im humanen Patienten gibt es derzeit nur die Möglichkeit der symptomatischen Behandlung. In den USA ist Nitazoxanid zur Behandlung der durch Kryptosporidien verursachten Diarrhoe zugelassen. Es gibt momentan keinen anwendbaren Impfstoff zur Bekämpfung der Kryptosporidiose. Zur medikamentösen Behandlung der Kryptosporidiose im Kalb sind in Deutschland die Mittel Gabbrovet® und Halocur® zugelassen, welche die Oozystenausscheidung und klinische Ausprägung der Symptomatik mindern. |
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Akute direkt oder indirekt nachgewiesene Humaninfektionen sind in Deutschland meldepflichtig. Nichtsdestotrotz gibt es vermutlich eine hohe Dunkelziffer humaner Infektionen durch oftmals fehlende Diagnostik. Infektionen bei Tieren sind in Deutschland nicht meldepflichtig. |
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Der Etablierung neuer Therapiemöglichkeiten gegen Kryptosporidien beim Menschen wird eine entscheidende Bedeutung beigemessen, wobei die Erforschung der Parasitenentwicklung im Wirt eine hohe Priorität hat. Dafür werden Omics-Technologien verwendet, die auf verschiedene Entwicklungsstadien im Wirt abzielen. Dies kann zur Identifizierung von Genen oder Proteinen beitragen, die bei der Entwicklung von Cryptosporidium sp. eine wichtige Rolle spielen und somit potenzielle Angriffspunkte für zukünftige Therapien sein könnten. Darüber hinaus werden auch potentielle Modelle für die Entwicklung von Impfstoffen unter Verwendung neuer Methoden zur Attenuierung wie Bestrahlung oder Gentechnik, einschließlich CRISP/Cas9 untersucht. Solche Studien werden in Tiermodellen (z.B. Knockout-Mäusestämmen) oder in In-vitro-Modellen durchgeführt. Es gibt eine Reihe von Zelllinien, die üblicherweise für die In-vitro-Infektion mit Cryptosporidium verwendet werden. In den letzten Jahren hat zusätzlich die Verwendung von Organoid-Modellen vielversprechende Ergebnisse bei der In-vitro-Generierung verschiedener Entwicklungsstadien von Cryptosporidium erbracht. Dies scheint erfolgsversprechend für ein künftiges Modell der kontinuierlichen In-vitro-Kultur von Cryptosporidium. Des Weiteren werden epidemiologische Studien durchgeführt, um das Vorkommen verschiedener Cryptosporidium-Arten und ihrer Genotypen bei Menschen, Haustieren, Wildtieren und Lebensmitteln zu untersuchen. |
Welche Bekämpfungsstrategien gibt es? |
|
Von großer Bedeutung bei der Bekämpfung der Kryptosporidiose sind Reinigungs- und Hygienemaßnahmen. Diese beinhalten bspw. das sorgfältige Händewaschen nach möglichen Erreger-Kontakt, das Abkochen von Trinkwasser unklarer Herkunft und das Reinigen von rohen Lebensmitteln vor dem Verzehr. Bedingt durch die stabile Oozystenwand der Umweltstadien dieser Erreger sind nicht alle Desinfektionsmittel in der Lage diese zu inaktivieren. Zur Bekämpfung eignen sich v.a. kresolbasierte Produkte; eine Listung wirksamkeitsgeprüfter Desinfektionsmittel erfolgt durch die Deutsche Veterinärmedizinische Gesellschaft (DVG). |
Wo liegen zukünftige Herausforderungen? |
|
Die besondere Lokalisation von Cryptosporidium in der Wirtszelle (intrazellulär aber nicht intrazytoplasmatisch) erschwert die Entwicklung gezielt wirkender Arzneimittel. Zudem stehen bislang keine In-vitro-Modelle für die Erzeugung von Oozysten zur Verfügung, weshalb weiterhin Tiermodelle verwendet werden müssen. |
|
Sonstiges |
https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Kryptosporidiose.html |
Für die fachliche Unterstützung bei der Erstellung der Steckbriefes zu Kryptosporidien danken wir Dr. Cora Delling, Dr. Zaida Melina Rentería-Solis und Arwid Daugschies vom Institut für Parasitologie an der Veterinärmedizinischen Fakultät der Universität Leipzig.
April 2023 - Escherichia coli
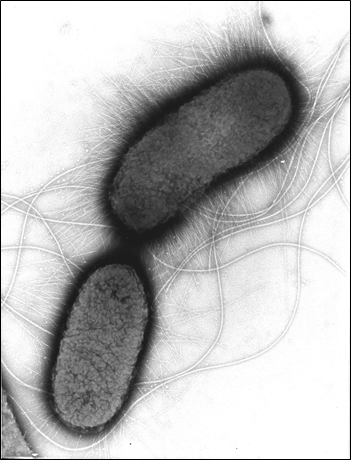
Abb.: E. coli O157 mit Flagellen und long polar fimbriae (lpf); Rasterelektronenmikroskopie, Balken 1 µm (Quelle: Gelderblom, Reissbrodt, RKI)
Beschreibung |
|
Escherichia coli (E. coli) sind Gram-negative, nicht sporenbildende, peritrich begeißelte, stäbchenförmige Bakterien von 1,1 µm -1,5 µm Durchmesser und 2 µm - 6 µm Länge. Sie gehören zur Familie der Enterobacteriaceae und sind fakultativ anaerob. Sie vermehren sich in einem Temperaturbereich von 7°C - 50 °C mit einer optimalen Wachstumstemperatur von 37°C. Die meisten Stämme der Spezies Escherichia coli können Laktose verstoffwechseln, was man sich für die Identifizierung und Isolierung durch Anzucht auf Selektivmedien zu Nutze macht. Insgesamt weist diese Spezies jedoch eine hohe Variabilität im Stoffwechsel auf, die aus der Anpassung an verschiedenste ökologische Nischen resultiert. E. coli lassen sich anhand ihrer Lipopolysaccharidstrukturen auf der Oberfläche (O-Antigene) und der Proteinstruktur ihrer Flagellen (H-Antigene) in sogenannte Serotypen einteilen. Ein bekanntes Beispiel hierfür ist der Serotyp O157:H7. Zudem bilden einige E. coli-Stämme Kapseln aus, die eine Persistenz in unwirtlichen Umgebungen gewährleistet. E. coli kommen als Kommensale vor, sind aber fakultativ pathogen, das heißt nicht alle, aber bestimmte Stämme können bei Menschen und/oder Tieren teils schwerwiegende Erkrankungen hervorrufen. Hierzu zählen zum einen die Erreger, die ihren Wirkort im Darm haben und zu Durchfallerkrankungen führen wie enteropathogene E. coli (EPEC), enterotoxische E. coli (ETEC), enteroinvasive E. coli (EIEC) und enteroaggregative E. coli (EAEC). Zum anderen gibt es die Gruppe der uropathogenen E. coli (UPEC), welche Harnwegsinfektionen verursachen und die neonatale Meningitis-verursachenden E. coli (NMEC), welche bei Säuglingen zu Gehirnhautentzündung führen. Die wichtigsten Zoonoseerreger dieser Spezies gehören zur Gruppe der Shigatoxin-bildenden E. coli (STEC), welche das namensgebende Shigatoxin bilden. Früher war dafür auch der Begriff Verotoxin-bildende E. coli (VTEC) gebräuchlich. STEC, die beim Menschen schwerwiegende Erkrankungen auslösen, werden als enterohämorrhagische E. coli (EHEC) bezeichnet. Da sich die Differenzierung dieser Gruppe (Pathovar/Pathotyp) durch die nötige Abgrenzung von apathogenen E. coli-Stämmen schwierig gestaltet, konzentriert man sich heute in der Diagnostik zuerst auf den Nachweis von Shigatoxin oder Shigatoxin-kodierenden Bereichen aus dem Genom dieser Erreger, den stx-Genen. Es gibt aktuell zwei Familien der Shigatoxine (Stx1 und Stx2) mit verschiedenen Subtypen (1a-1d, 2a-2o). Diese Gene kommen bei E. coli-Stämmen vor, die zu einem von ca. 200 verschiedenen O-Serotypen gehören können. Toxintyp und Serotyp des Stammes sind in vielfältigen Kombinationen anzutreffen, die sehr unterschiedliche Symptome hervorrufen können. Durch zusätzliche Virulenzfaktoren, können sie Eigenschaften anderer E. coli Pathovare oder auch anderer Erreger aufnehmen, die sie befähigen sich noch effektiver an ihre Umgebung anzupassen. Den Darm von Schweinen können besondere Stämme kolonisieren, die den Toxintyp Stx2e tragen und die Ödemkrankheit auslösen können (edema diesease-causing E. coli; EDEC). Diese Stämme sind für den Menschen von geringer Gefahr |
Erstmals entdeckt |
|
E. coli wurden schon 1885 durch den österreichischen Kinderarzt Theodor Escherich aus dem Stuhl eines Kindes isoliert und als „bacterium coli commune“ beschrieben. Die Gruppe der STEC wurde erstmals 1977 durch Konowalchuk et al. beschrieben und 1982 bei einem lebensmittelbedingten Ausbruch verursacht durch nicht durcherhitzte Hamburger in den USA international bekannt. Zunächst wurden die Bakterien Verotoxin-bildende E. coli (VTEC) genannt, da die Wirkung des von diesen Bakterien gebildeten Toxins in Zellkulturtests mit sogenannten Verozellen (Nierenzellen der grünen Meerkatze) nachgewiesen werden konnte. Da das Toxin in der Struktur sehr stark dem von Shigella dysenteriae gebildeten Toxin ähnelt, wurde gleichwertig auch der Name „Shiga-like Toxin“ benutzt. Heutzutage wird vorrangig die Bezeichnung Shigatoxin verwendet und damit von Shigatoxin-bildenden oder Shigatoxin–produzierenden E. coli (STEC) gesprochen. |
Wo kommt der Erreger vor? |
|
STEC kommen weltweit vor und sind vor allem im Darm und damit auch im Kot von Rindern und anderen Wiederkäuern wie Schaf, Ziege oder Reh zu finden. STEC wurden auch bei vielen anderen Säugetieren (z. B. Schwein, Hund, Pferd, Hase, Katze, Alpaka/Lama, Wasserbüffel), Vögeln (z. B. Huhn, Taube, Truthahn), Insekten (z. B. Fliege, Käfer) und weiteren nachgewiesen. Untersuchungen weltweit haben gezeigt, dass bis zu 86 % der Rinder STEC mit dem Kot ausscheiden. Daten aus dem Zoonose-Monitoring in Deutschland zeigen Prävalenzen für STEC-positive Tiere von ca. 20 - 25 % bei Mastrindern und -kälbern und ca. 40 % der Wildwiederkäuer (hier Rehwild). Untersuchte Lebensmittel waren bei etwa 2-3 % der Rindfleisch- und Rohmilchproben und >16 % der Rehfleischproben STEC-positiv. Pflanzliche Lebensmittel wie Pflücksalate, Blattgemüse u. ä. waren in 1 % der Proben STEC positiv, wohingegen Weizenmehl in 9 % der untersuchten Proben STEC enthielten. |
Betroffene Tierspezies, Reservoir |
|
STEC besiedeln den Darm von Wiederkäuern wie Rindern, Schafen, Ziegen aber auch von Wildwiederkäuern wie z. B. Rehen. Rinder können schon im Kälberalter mit geringen Dosen der Erreger infiziert werden. Nach initialer Vermehrung besiedeln STEC die Darmschleimhaut dauerhaft und werden über Monate hinweg ausgeschieden. Grundsätzlich verlaufen Infektionen bei diesen Tieren symptomlos. Nur bei Kälbern können gelegentlich durchfallartige Erscheinungen auftreten, wenn die STEC-Stämme auch über Eigenschaften von EPEC- oder ETEC-Stämmen verfügen. Im Darm erwachsener Tiere verhalten sich STEC wie kommensale Bakterien und werden zwischen den Einzeltieren einer Herde übertragen. In Zeiten geringer Exposition, z.B. während der Weidezeit, kann die Ausscheidung vorübergehend unter die Nachweisgrenze fallen, aber derselbe STEC-Klon kann sich in der Einzelherde über Monate und Jahre erhalten. Die kurzzeitige Ausscheidung hoher Anzahlen an STEC durch einzelne Tiere (definiert als über 10.000 Keime pro Gramm Kot), die sogenannte Superausscheidung, ist die Hauptquelle für die Verunreinigung der Umwelt und die Übertragung der Erreger von einem Tier auf das nächste. Diese Superausscheidungsereignisse bestimmen auch das von Rindern ausgehende Risiko des Menschen sich eine STEC-Infektion zuzuziehen. |
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Über den Kot gelangen die Bakterien in die Umwelt und auf diverse Lebensmittel tierischen und pflanzlichen Ursprungs. Auch die direkte Übertragung zwischen Tier und Mensch und von Mensch zu Mensch ist möglich. STEC, die beim Menschen schwerwiegende Erkrankungen auslösen, werden als enterohämorrhagische E. coli (EHEC) bezeichnet. Mit Keimzahlen von unter 100 KbE ist die Infektionsdosis vergleichsweise gering. Als Hauptübertragungsweg für EHEC/STEC gilt kontaminiertes und nicht ausreichend gegartes Rindfleisch und Rohmilch bzw. Rohmilchprodukte. Inzwischen werden die meisten beschriebenen Ausbrüche weltweit jedoch durch pflanzliche Lebensmittel (verzehrfertige Salate, Mehl bzw. Fertigteig) verursacht. Der bisher zahlenmäßig größte EHEC-Ausbruch (Serotyp O157:H7), bei dem 12.680 Personen erkrankten, fand 1996 in Sakai City in Japan statt. Die Personen, hauptsächlich Schulkinder, hatten im Rahmen der Schulspeisung, kontaminierte Rettichsprossen gegessen. 2011 fand in Deutschland der schwerste EHEC-Ausbruch (Serotyp O104:H4) bisher statt, bei dem 3842 Personen erkrankten und 53 Personen starben. Auch hier wurden kontaminierte Sprossen (Bockshornklee) bzw. deren Samen mit dem Ausbruch assoziiert. Die Ursache für die Schwere des Ausbruchs liegt wahrscheinlich in der Tatsache begründet, dass der Auslöser des Ausbruchs ein Hybridstamm war, der sowohl Eigenschaften von enterohämorrhagischen (Shigatoxinbildung) als auch von enteroaggregativen (starke Adhärenz) E. coli besaß. Weiterhin gilt der Kontakt zu Tieren, besonders Paarhufern, wie z. B. beim Besuch auf dem Bauernhof oder im Streichelzoo, als Quelle für eine Infektion. Besonders gefährdet sind Kinder unter 5 Jahren und immunsupprimierte Personen. |
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Die meisten Tiere zeigen keine Krankheitssymptome bei einer STEC-Infektion, auch nicht mit Stämmen, die den Menschen krankmachen können. Die Ödemkrankheit, die von EDEC verursacht werden kann, ist eine akute, schwere, oft tödliche Krankheit der Ferkel kurz nach dem Absetzen. Die Krankheitserscheinungen werden im Wesentlichen durch das Stx2e ausgelöst, das, vom Darm aufgenommen, im ganzen Körper Schädigungen an den kleinen Blutgefäßen hervorruft. In der Folge entwickeln sich Ödeme in der Unterhaut, der Schleimhaut im Kehlkopfbereich und im Magen. Gefäßschäden im Gehirn ziehen neurologischen Erscheinungen, wie Bewegungsstörungen und Krampfanfälle bis zum Festliegen nach sich. Beim Menschen können EHEC/STEC-Infektionen wässrige bis blutige Durchfälle auslösen, die in seltenen Fällen auch in einem Nierenversagen, durch ein hämolytisch-urämisches Syndrom (HUS) münden können. In Einzelfällen, vor allem bei kleinen Kindern, kann dies zum Tode führen. Es werden durch EHEC/STEC auch mitunter immer wiederkehrende Darmprobleme hervorgerufen und eine lange symptomlose Ausscheidung bewirkt. |
Gibt es Medikamente oder einen Impfstoff? |
|
Zum Schutz des Menschen vor den Folgen einer EHEC-Infektion gibt es bis heute trotz zahlreicher Entwicklungsversuche keinen Impfstoff. Schweine lassen sich mit Impfstoffen, die Antikörper gegen den Toxintyp Stx2e oder gegen Anheftungsfaktoren der Bakterien im Darm erzeugen, vor den Symptomen der Ödemkrankheit schützen. |
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Der öffentliche Gesundheitsdienst (ÖGD) erfasst Erkrankungsfälle mit EHEC/STEC und übermittelt diese gemäß §6 und §7 des Infektionsschutzgesetzes (IfSG) an das Robert Koch-Institut (RKI). Proben dieser Fälle werden in Speziallaboren (Landeslabore, NRZ Salmonellen und andere bakterielle Enteritiserreger, KL HUS) subtypisiert und analysiert. Gemäß §13 IfSG wird dort eine molekulare Surveillance durchgeführt, d.h. von diesen Erregern wird das Genom sequenziert und auf Ähnlichkeiten zu Vergleichsproben geprüft. So können sowohl Häufungen (Cluster) als auch neuartige Erreger erkannt und die Erregervielfalt überwacht werden. Im Lebensmittelbereich gibt es im Rahmen der VO (EG) Nr. 2073/2005 mikrobiologische Kriterien für STEC bezüglich Sprossen, die von den Herstellern eingehalten werden müssen. |
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Eine zentrale Forschungsfrage ist die Verbesserung der Methoden für den Nachweis und die Isolierung der STEC aus den verschiedenen Matrices, da eine Abtrennung zu den nicht-pathogenen E. coli sehr aufwendig ist. Obwohl zunehmend Genominformationen für STEC zur Verfügung stehen, ist es nach wie vor schwierig die Virulenz eines STEC-Stamms aus diesen Daten vorherzusagen und damit potentielle EHEC zu identifizieren. Basierend auf epidemiologischen Daten und nach Einschätzung eines Expertengremiums der WHO und FAO gibt es eine hierarchische Risikocharakterisierung, welche die STEC mit einer genetischen Kombination aus stx2a und Adhärenz-assoziierten Faktoren, kodiert durch eae oder aggR, auf die höchste Stufe stellen. Weitere Forschung wird jedoch benötigt. Aktuell wird außerdem der Ausbau der genomischen Surveillance über alle Bereiche (Veterinär, Lebensmittel und Human) vorangetrieben, um zukünftig Infektketten schneller identifizieren zu können und Ausbrüche im Idealfall zu verhindern. Außerdem können diese Daten auch genutzt werden um noch unbekannte Reservoire zu identifizieren, da die Unterschiede in den gefundenen STEC-Typen aus dem Tier und/oder Lebensmittel im Vergleich zu STEC aus dem Humanbereich nach wie vor Fragen aufwirft. Insbesondere stehen auch pflanzliche Lebensmittel wie Mehl im Fokus um mögliche weitere Übertragungswege von STEC auf den Menschen zu erkennen. Zudem gilt es die Persistenz unterschiedlich virulenter Stämme in den Reservoirwirten besser zu verstehen, um den Beitrag zum Infektionsgeschehen abschätzen zu können. Obwohl bei EHEC/STEC bisher selten beschrieben und auf Grund der Anwendung in der Therapie in der Humanmedizin nicht relevant, steht die Resistenzentwicklung insbesondere zu den Reserveantibiotika wie Meropenem und Colistin unter ständiger Beobachtung. |
Welche Bekämpfungsstrategien gibt es? |
|
Versuche über die Impfung von Rindern die Ausscheidung von STEC zu reduzieren und damit sowohl die Umweltkontamination als auch den Übertrag in tierische Lebensmittel einzudämmen, haben sich in der Praxis als nicht erfolgreich erwiesen. Derzeit gibt es keine wirksame Strategie zur Bekämpfung der STEC im tierischen Reservoir. Im Lebensmittel werden STEC durch Erhitzungsverfahren wie Kochen, Braten, Backen und Pasteurisieren wirksam abgetötet. Voraussetzung ist, dass für mindestens zwei Minuten eine Temperatur von 70°C an allen Stellen des Lebensmittels erreicht wird. Gegenüber anderen Umwelteinflüssen, beispielsweise einem sauren Milieu, Kälte, Austrocknung oder hoher Salzkonzentration, sind diese Bakterien jedoch relativ unempfindlich. Auch durch Tiefgefrieren von Lebensmitteln lassen sich STEC nicht abtöten |
Wo liegen zukünftige Herausforderungen? |
|
Herausforderungen für die Diagnostik von STEC aber auch für deren Lebensmittel-rechtliche Bewertung sind z.B. neue Lebensmittelmatrices wie Mehl, neue Verzehrgewohnheiten wie roher Keksteig oder neue Angebotsformen wie Rohmilchtankstellen. Zudem stellt uns die Plastizität des E. coli Genoms, welche zu hochvirulenten und/oder resistenten Stämme führen kann, aber auch die Frage was einen STEC zu einem EHEC macht, immer wieder vor neue Herausforderungen. |
|
Sonstiges |
Quellen/Weiterführende Literatur
|
Für die fachliche Unterstützung bei der Erstellung der Steckbriefes zu Escherichia coli danken wir Dr. Elisabeth Schuh (Bundesinstitut für Risikobewertung, Abteilung Biologische Sicherheit), Dr. Angelika Fruth (Robert Koch-Institut, Bereich Wernigerode) und Prof. Dr. Christian Menge (Friedrich-Loeffler-Institut, Institut für molekulare Pathogenese).
März 2023 - Denguevirus
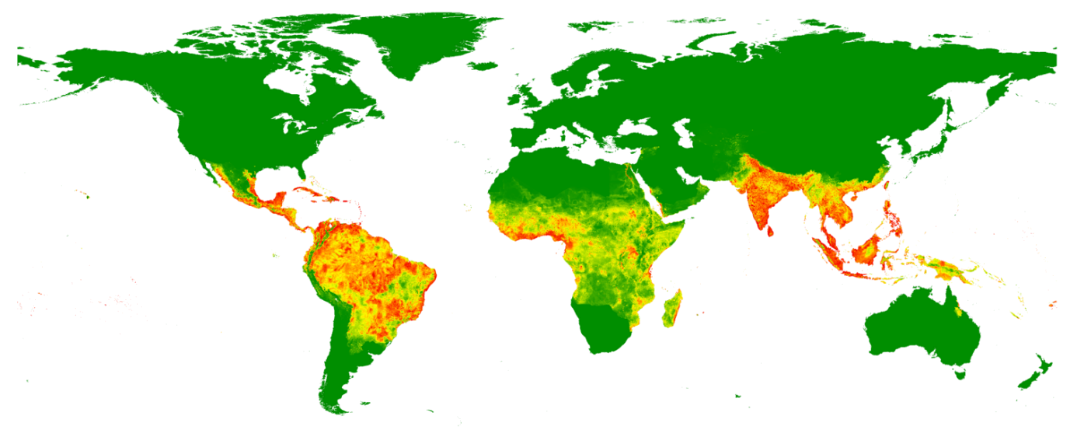
Abb.: Geschätztes Dengue Risiko weltweit, basierend auf Zahlen von 2010 (Bhatt, Gething et al. 2013), in rot Regionen mit hohem Risiko. Copyright – Bhatt, Nature, 2010
Beschreibung |
|
Dengueviren (vier Serotypen: DENV 1-4) verursachen eine akute fieberhafte Erkrankung. Wegen der zunehmenden Ausbreitung der übertragenden Moskitos (Aedes aegypti und Aedes albopictus) verursacht Dengue seit Jahrzehnten eine schleichende Pandemie. Das Dengue-Virus (DENV) ist ein behülltes Pathogen aus der Gattung der Flaviviren. Von Mücken übertragene Viren werden auch Arboviren (Arthopod-borne viruses) genannt. Unter allen von Arboviren ausgelösten Erkrankungen ist das Dengue-Fieber weltweit am häufigsten. Die Krankheitslast von DENV wird auf ca. 400 Millionen Erkrankungen und 10.000 Todesfälle pro Jahr geschätzt.. |
Erstmals entdeckt |
|
Der Erreger wurde in den frühen 1940er Jahren in Asien entdeckt (Ren Kimura und Susumu Hotta) und isoliert (Albert B. Sabin und Walter Schlesinger). |
Wo kommt der Erreger vor? |
|
Alle vier Serotypen kommen weltweit vor. Die höchsten Übertragungsraten für Dengue werden in Südostasien und in Lateinamerika beobachtet. Für Afrika ist die Datenlage über die Häufigkeit von Dengue weniger gut beschrieben. |
Betroffene Tierspezies, Reservoir |
|
Man unterscheidet urbane und sylvatische Zyklen. Dengue-Viren haben sich vor längerer Zeit aus ihrem sylvatischen Zyklus gelöst und werden fast immer in urbanen Zyklen zwischen Menschen und Aedes Mücken übertragen. Es gibt jedoch vereinzelte Infektionen von Menschen mit Dengue-Viren, die vermutlich in Waldregionen im Globalen Süden (beschrieben in Afrika und Asien, jedoch nicht in Lateinamerika) entstanden sind und auf Zirkulation genetisch unterschiedlicher Dengue-Viren in sylvatischen Zyklen in nicht-humanen Primaten hinweisen könnten. Dengue-Viren wurden mittels molekularer oder serologischer Nachweisverfahren in diversen Tieren nachgewiesen, u.a. Fledermäusen, Affen, und verschiedenen Nutztieren. Hier ist von „spillover“ Infektionen auszugehen, die nicht Teil eines etablierten Übertragungszyklus sind. |
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Die Übertragung geschieht durch infektiösen Stich einer weiblichen Aedes Stechmücke. Risikogruppen für schwere Verläufe sind Menschen mit Vorerkrankungen sowie Menschen, die eine Infektion mit einem zweiten Serotyp durchmachen, der sich von dem ersten Serotyp unterscheidet, vermutlich unter anderem durch infektionsverstärkende nicht-neutralisierende Antikörper (engl. antibody dependent enhancement, ADE). |
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Beim Menschen verlaufen 50-60% Erkrankungen oligosymptomatisch, oft ohne Inanspruchnahme einer Gesundheitsversorgung. Symptomatische Dengue-Erkrankungen verlaufen klinisch unter dem Bild eines hochfieberhaften Infekts, typischerweise mit Gelenk-, und Kopfschmerzen sowie oft mit makulopapulösem Exanthem. Im Blutbild findet sich eine Thrombopenie und ggf. auch eine Leukopenie. In seltenen Fällen kann es zu schweren Verlaufsformen mit Kreislaufversagen und Blutungen kommen. Der wichtigste Pathomechanismus schwerer Dengue-Verläufe ist durch eine erhöhte Kapillarpermeabilität - das sogenannte „vascular leakage“ Syndrom - bedingt, das mit serösen Flüssigkeitsansammlungen (z.B. Pleuraerguss, Aszites), Blutdruckabfall, und Minderperfusion von lebenswichtigen Organen bis hin zum Schock einhergeht. |
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt keine antiviralen Medikamente, aber zwei Impfstoffe, die in einigen Ländern zugelassen wurden (tetravalente Lebendimpfstoffe, Dengvaxia®, QDenga®). Weitere Impfstoffe sind in der klinischen Erprobung. Bei mindestens einem dieser Impfstoffe ist ein erhöhtes Risiko einer schwer verlaufenden ersten Dengue Erkrankung durch ADE beschrieben worden, weshalb der Impfstoff in einigen Ländern nur noch bei bereits vorher mit Dengueviren Infizierten empfohlen wird. |
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Dengue ist in Deutschland meldepflichtig (als Labordiagnose). Weltweit werden Surveillance Daten gesammelt, wobei jedoch die Definitionen unterschiedlich sind. Oft wird nur ein kleiner Anteil der gemeldeten Fälle durch spezifische Labordiagnostik bestätigt. Die Vorhersage von Dengue Epidemien wurde intensiv erforscht, bisher ohne greifbaren Erfolg. |
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Die Pathogenese einer schweren Dengue-Infektion ist nur unzureichend verstanden. Eine vorangegangene Infektion mit einem heterogenen (unterschiedlichen) Serotyp kann eine Infektion mit einem zweiten Serotyp verstärken. Der Grund hierfür ist das sogenannte antibody-dependent enhancement (ADE), wobei nicht-neutralisierende Antikörper gegen den vorherigen DENV Serotypen die Aufnahme des aktuell infizierenden Serotypen in normalerweise wenig oder nicht empfängliche Zellen über Fcy-Rezeptoren verstärken, was wiederum die Virusmenge erhöhen kann. Daher werden dringend dynamische und früh reaktive Biomarker benötigt, um einen schweren Verlauf einer Dengue-Infektion während eines Ausbruchs vorhersagen zu können und die entsprechende Patientenversorgung einleiten zu können. Auf der Bevölkerungsebene wird versucht, Dengue-Ausbrüche oder Epidemien vorherzusagen, um früh genug Kontrollmaßnahmen einleiten zu können. Ein Schwerpunkt der Forschung ist die Immunologie, um die Wechselwirkungen zwischen den vier DENV Serotypen und auch mit anderen verwandten Viren (z.B. Zikavirus) besser verstehen zu können. Während häufige Denguevirus-Infektionen vermutlich zumindest vor Ausbildung einer kongenitalen Zikavirus-Infektion schützen könnten, könnte eine vorangegangene Zikavirus-Infektion zu schwereren Dengue Verläufen führen. |
Welche Bekämpfungsstrategien gibt es? |
|
Wo liegen zukünftige Herausforderungen? |
|
Im Zuge des Klimawandels wird damit gerechnet, dass sich Dengue weiter nach Norden ausbreitet, weil sich die übertragenden Moskitos ausbreiten. Extremwetterereignisse wie Überflutungen und Hitzewellen können diese Dynamik verstärken. Ungeplante Urbanisierung und fehlende städtische Infrastruktur (Müllentsorgung bzw. Wasserversortung) sind die wichtigsten Herausforderung in den Regionen des globalen Südens, in denen Dengue endemisch ist. Die Krankheit ist ferner assoziiert mit Phänomenen der Globalisierung, wo z.B. durch den Handel mit alten Autoreifen Larven von Moskitos in Ländern eingeschleppt wurden, in denen bisher diese Moskitos nicht heimisch waren. |
Für die fachliche Unterstützung bei der Erstellung der Steckbriefes zu Dengueviren danken wir PD Dr. Thomas Jaenisch (Heidelberg Institut für Global Health, Universitätsklinikum Heidelberg & Center for Global Health, Colorado School of Public Health, Aurora, CO, USA) und Prof. Dr. Jan Felix Drexler (Charité-Universitätsmedizin Berlin, Mitglied der Freien Universität Berlin und Humboldt-Universität zu Berlin, Institut für Virologie, Berlin).
Februar 2023 - Yersinia pestis
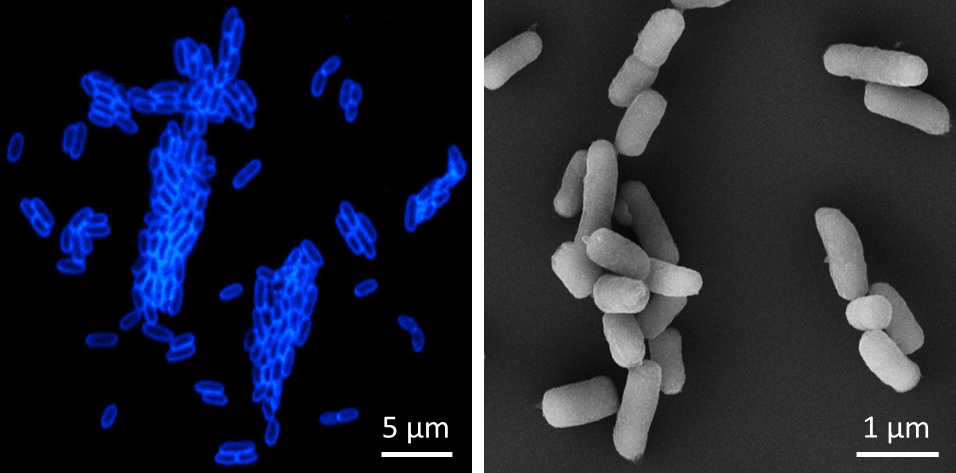
Abb.: Links – Fluoreszenzmikroskopische Aufnahme von Y. pestis Zellen, die mit einem Bakteriophagen-Rezeptorbindeprotein-Reporter (als Fusion mit dem fluoreszierenden Protein mTagBFP2) gefärbt wurden, das hochspezifisch nur an Y. pestis bindet. Rechts – Rasterelektronenmikroskopische Aufnahme von Y. pestis Zellen. Copyright: Institut für Mikrobiologie der Bundeswehr
Beschreibung |
|
Die Gattung Yersinia (Y.) mit ihrem berüchtigtsten Vertreter Yersinia pestis, dem Erreger der Pest, gehört taxonomisch zur Ordnung Enterobacteriales. Die nächsten Verwandten von Y. pestis sind Yersinia pseudotuberculosis und Yersinia enterocolitica, die beim Menschen fieberhafte Magen-Darm-Erkrankungen (Yersiniosen) auslösen. Y. pestis ist ein fakultativ anaerobes Stäbchenbakterium ohne Geißeln. Die Bakterienzellen sind 0,5 – 0,8 µm breit und 1 – 1,3 µm lang. Auf festen Kulturmedien wächst der Erreger langsam und bildet nach 24 Stunden winzige, nach 48 Stunden 1-2 mm große, grauweiße Kolonien. Die optimale Wachstumstemperatur liegt bei 28°C. Für die Entwicklung des spezifischen F1-Antigens, auf dessen Nachweis viele immunchromatographische Schnelltests basieren, ist jedoch eine Inkubation oberhalb von 33°C erforderlich. Der Erreger hat sich phylogenetisch wahrscheinlich erst vor etwa 2000 bis 6000 Jahren aus Y. pseudotuberculosis durch Genomreduktion und Akquirierung zweier Virulenzplasmide (pMT1 und pPla) in Anpassung auf ihre Wirte zu einem obligaten Pathogen entwickelt. Dabei war der Verlust von Insektentoxinen zusammen mit der gesteigerten Fähigkeit, Biofilme in Flöhen zu bilden, ein wichtiger Schritt in der Evolution von Y. pestis. Dies ermöglichte den von Vektoren abhängigen Lebensstil in Flöhen und damit die Übertragung durch Stiche infizierter Insekten. Das Plasmid pMT1 mit 100 – 110 kb kodiert für das kapsuläre F1-Glykoprotein-Antigen und das „Yersinia murine toxin“ (Ymt), die das Überleben von Y. pestis im Flohdarm ermöglichen. Die Kapsel von Y. pestis ist eine Virulenz-assoziierte Oberflächenstruktur, welche durch das Strukturgen caf1 kodiert wird. Dieses kapsuläre F1-Glykoprotein-Antigen schützt vor der phagozytischen Aktivität in Säugetieren und verhindert die Aufnahme des Erregers durch Makrophagen und Epithelzellen. Das mit ca. 9,5 kb kleinste Virulenzplasmid pPla kodiert für den Plasminogen-Aktivator (Pla), der als wichtiger Virulenzfaktor für die periphere Verbreitung im Wirt gilt, sowie für das Toxin Pesticin, das durch Hydrolyse der Peptidoglykanwand andere Bakterien der gleichen ökologischen Nische abtöten kann. Das Virulenzplasmid pCD1 ist 70 – 75 kb groß und den drei humanpathogenen Yersinia-Spezies gemein. Es kodiert für ein Typ-III-Sekretionssystem (T3SS) und den Virulenzfaktor „Yersinia Outer Proteins“ (YOPs) und weitere Proteine, die zusammen die Immunreaktion des Wirtes unterdrücken, sowie Gene für die Synthese des Siderophors „Yersiniabactin“. |
Erstmals entdeckt |
|
Die Pest ist eine kulturhistorisch bedeutsame und seit Jahrhunderten bekannte Erkrankung, deren Ätiologie lange im Dunkeln lag. Erste Infektionsschutzkonzepte („Quarantäne“, „Schnabelmaske“) sind mit ihr verbunden. Yersinia pestis ist für drei historisch belegte Pest-Pandemien verantwortlich, die schätzungsweise insgesamt über 200 Millionen Todesopfer zur Folge hatten: die „Justianische Pest“ von 541 – 750/767 n. Chr., der „Schwarze Tod“ von 1346 bis in das frühe 19. Jahrhundert, sowie eine noch andauernde Pest-Pandemie von der Mitte des 19. Jahrhunderts bis heute. Erst mit dem zunehmenden Verständnis zur Ursache verschiedener Infektionskrankheiten und der Entwicklung der Bakteriologie als wissenschaftliche Disziplin ab Mitte/Ende des 19. Jahrhunderts waren die Grundlagen zur Entdeckung gegeben. Der Pesterreger wurde 1894 von dem schweizerisch-französischen Arzt und Bakteriologen Alexandre Yersin, einem Mitarbeiter Louis Pasteurs, in einem dramatischen wissenschaftlichen Wettrennen mit seinem japanischen Konkurrenten und Koch-Schüler Kitasato Shibasaburo isoliert und zunächst als Pasteurella pestis beschrieben. Erst 1970 erhielt das Bakterium seinen heutigen Namen, der den Beitrag Yersins würdigt. |
Wo kommt der Erreger vor? |
|
Obwohl die Pest, die mit ihren Seuchenzügen weite Teile der Welt eroberte, seit Ende des 2. Weltkriegs in Mittel- und Westeuropa als ausgerottet gilt, existieren weiterhin natürliche Pestherde in mehreren Ländern Afrikas, Asiens und Amerikas. Aktuelle Schwerpunktgebiete befinden sich in (Ost)-Afrika, besonders in Madagaskar und der Demokratische Republik Kongo. Weiterhin sind auch Länder in Asien (Mongolei, Vietnam, Myanmar und Indien) sowie auf dem amerikanischen Kontinent (Peru und der Westen der USA) regelmäßig von Pestausbrüchen betroffen. Durch die weltweit jährlich etwa 2000 Fälle besteht aufgrund der hohen Mobilität der Weltbevölkerung prinzipiell das Risiko einer Verbreitung des Erregers auch in nicht-endemische Gebiete. |
Betroffene Tierspezies, Reservoir |
|
Der Erreger ist bei der Wahl seiner Reservoirwirte nicht allzu wählerisch: Zahlreiche Säugetierarten und mehr als 30 Flohspezies können infiziert werden. Zur Aufrechterhaltung der Infektionszyklen in den Endemiegebieten kommt aber den Nagetieren und deren Flöhen die größte Bedeutung zu, während der Mensch nur ein zufälliger (akzidenteller) Wirt ist. |
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Pest-Infektionen können durch den Stich eines infizierten Flohs, den direkten Umgang mit infiziertem Tiergewebe, die Aufnahme von infektiösem Material oder durch Tröpfcheninfektion verursacht werden. Der Pest-Erreger ist hoch infektiös, lediglich 1 – 10 Bakterien reichen aus, um bei Nagetieren und Primaten eine Infektion auszulösen. Y. pestis kann auch vorsätzlich ausgebracht werden und wird im Kontext bioterroristisch relevanter Erreger zu den Bakterien mit höchstem Gefährdungspotenzial gezählt, da er von Mensch zu Mensch übertragen werden und die Erkrankung mit einer hohen Sterblichkeit verbunden sein kann. |
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Die Symptomatik der Pest kann nach einer Inkubationszeit von 1 – 7 Tagen anfangs unspezifisch sein und denen anderer Krankheiten ähneln, wodurch sich die Diagnose verzögern kann. Im weiteren Verlauf entwickeln sich die charakteristischen Krankheitsbilder. Infektionen durch Flohstiche führen typischerweise zur sogenannten Beulenpest. Bei dieser häufigsten Krankheitsform wandert der Pest-Erreger über das Lymphgefäßsystem zum nächstgelegenen Lymphknoten und besiedelt diesen. Durch eine rasche lokale Vermehrung der Bakterien entwickelt sich eine Lymphadenitis. Die druckschmerzhaften Schwellungen der Lymphknoten werden auch als Bubo bezeichnet. Sie enthalten ein infektiöses, eitriges Sekret und können gelegentlich aufplatzen. Eine unbehandelte Beulenpest weist eine Letalität bis zu 60 % auf, die jedoch durch Antibiotika-Behandlung deutlich verringert werden kann. Bleibt die Beulenpest unbehandelt, kann sich der Erreger innerhalb weniger Tage im Körper weiter ausbreiten und erreicht so Milz, Leber und andere Organe. Bei dieser als Pestsepsis bezeichneten Komplikation liegt die Letalität deutlich höher. Durch die Ausbreitung kann der Pest-Erreger auch die Lunge erreichen und so eine sekundäre Lungenpest verursachen. Erfolgt die Infektion der Lunge beispielsweise im Rahmen von Ausbrüchen direkt aerogen über Tröpfchen, führt dies zur deutlich fulminanter verlaufenden primären Lungenpest. Neben Fieber, schwerem Krankheitsgefühl und Kopfschmerzen steht dann die Lungensymptomatik mit Luftnot, Brustschmerzen und teils blutigem Husten im Vordergrund. Ohne frühzeitige antibiotische Behandlung führt diese Form immer zum Tod. Bei Tieren zeigen sich je nach Übertragungsweg und Ausbreitung im Organismus grundsätzlich ähnliche Symptome wie Fieber, Appetitlosigkeit, Lethargie oder Lymphknoten-schwellung. Insbesondere bei Nagetieren können auch nur leichte Verläufe auftreten. |
Gibt es Medikamente oder einen Impfstoff? |
|
Die Behandlung einer Pest erfolgt zum einen mittels einer spezifischen antibiotischen Behandlung und zum anderen durch eine nicht-spezifische unterstützende Therapie. Die Behandlung der Infektion sollte insbesondere bei der Lungenpest möglichst innerhalb der ersten Stunden nach Symptombeginn beginnen, um den Therapieerfolg zu ermöglichen und die Überlebenschancen der Patienten zu verbessern. Als Antibiotika werden in erster Linie Aminoglykoside und Fluorchinolone eingesetzt. Bei bestimmten Konstellationen wie der selten auftretenden Pestmeningitits können auch alternative Substanzen wie Chloramphenicol in Betracht kommen. Die empfohlene Dauer einer möglichen Postexpositionsprophylaxe (PEP) für Kontaktpersonen beträgt sieben Tage. Zur Vermeidung von Sekundärfällen müssen Patienten bereits bei begründetem Verdacht einer Lungenpest konsequent isoliert werden. Bis jetzt existiert in der westlichen Welt kein zugelassener Impfstoff, der eine Langzeitimmunität gegen die Infektionskrankheit gewährleistet. Aus einer abgeschwächten (attenuierten) Deletionsmutante (pgm/hms-negativ) des Wildtyps wurde in der damaligen Sowjetunion (UdSSR) der abgeschwächte Pest-Lebendimpfstoff EV76 weiterentwickelt. Obwohl dieser Y. pestis EV76 in einigen Ländern der ehemaligen UdSSR immer noch verwendet wird, findet der Impfstoff in der westlichen Welt aufgrund seiner starken Nebenwirkungen (Reaktogenität) keinen Einsatz. Dennoch haben in den vergangenen 80 Jahren Millionen von Menschen den Lebendimpfstoff erhalten. In den letzten Jahren hat sich durch wiederkehrende Pestausbrüche, insbesondere durch die große Pestepidemie 2017 auf Madagaskar mit einem hohen Anteil von Lungenpestfällen und mehr als 200 Toten, und Befürchtungen einer vorsätzlichen Ausbringung des Erregers das Interesse an der Impfstoffentwicklung von staatlichen und privaten Forschungseinrichtungen verstärkt. Im Jahr 2018 führte die WHO 17 Impfstoff-Kandidaten in verschiedenen Entwicklungsstadien auf, so dass die Verfügbarkeit eines modernen und sicheren Impfstoffs in den nächsten Jahren wahrscheinlich ist. |
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Nach Infektionsschutzgesetz §6 und §7 ist sowohl die Erkrankung als auch der Labornachweis des Erregers ein meldepflichtiger Tatbestand, der umgehende Maßnahmen der Gesundheitsbehörden nach sich zieht. Allerdings sind in Deutschland in den letzten Jahrzehnten keine Pestfälle aufgetreten. Endemisch Länder haben teils besondere Überwachungs- und Bekämpfungsstrategien implementiert, wie beispielsweise die „National Strategy for the Prevention and Control of Plague“ in Madagaskar. Die Labordiagnostik ist allerdings in einigen von der Pest betroffenen Ländern problematisch, insbesondere in abgelegenen Gebieten des Globalen Südens, in denen Logistik, Infrastruktur, Meldesysteme, Hygiene- und Medizinstandards unzureichend sowie personelle und finanzielle Ressourcen begrenzt sind. Ein schneller und zuverlässiger Nachweis von Y. pestis ist jedoch zwingend erforderlich, da die Vermeidung eines womöglich tödlichen Krankheitsverlaufs nur durch eine frühzeitige Antibiotika-Therapie erreicht werden kann. Der Goldstandard für die Diagnose einer Y. pestis-Infektion und Voraussetzung für eine phänotypische Empfindlichkeitsprüfung ist die Kultur nach Isolierung des Erregers aus verschiedenen klinischen Materialien. Neben Blutkulturen sind dabei insbesondere tiefe respiratorische Materialien (bei v.a. Lungenpest) und Abzesspunktat (bei v.a. Bubonenpest) geeignet. Zur Identifizierung sind verschiedene biochemische, massenspektrometrische, immunologische oder molekularbiologische Nachweisverfahren etabliert. Als Zielgene haben sich das Plasminogen-Aktivator-Gen (pla) und das Gen des F1-Antigens (caf1) in verschiedenen PCR-Formaten bewährt. Beide Teste können als Multiplex-PCR, ggf. auch in Kombination mit weiteren Markern (inv, yopM oder pst), durchgeführt werden. Als neue Methode kann Y. pestis mit Hilfe von Rezeptorbindeproteinen (RBPs) aus Bakteriophagen nachgewiesen werden. Hier werden die RBPs von hochspezifischen diagnostischen Bakteriophagen biotechnologisch als Fusion mit einem Reporterprotein (z.B. einem Fluoreszenzprotein) produziert und so als molekulare Sonden für den schnellen Erregernachweis, z.B. mittel Fluoreszenzmikroskopie, eingesetzt. Serologische Verfahren zum Nachweis von spezifischen Antikörpern spielen in der Akutdiagnostik keine Rolle, können aber im Rahmen sero-epidemiologischer Untersuchungen (darunter auch in Reservoirtieren) eingesetzt werden. |
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Neben der Erforschung der Pathogenitätsmechanismen von Pest sowie deren Epidemiologie, hat Y. pestis in den letzten Jahren vor allem im Bereich der Paläogenetik für Aufsehen gesorgt. Hier wurden teils jahrtausendealte Pestopfer genetisch untersucht und so die Genome der Krankheitserreger rekonstruiert, die nun genauere Rückschlüsse über die Evolution von Y. pestis und dessen Einfluss auf die Menschheitsgeschichte liefern. Ein weiteres Forschungsfeld stellen Bakteriophagen dar, die Y. pestis infizieren. Basierend auf diesen hochspezifischen Viren werden alternative Therapiemöglichkeiten (Phagentherapie) und Diagnostika (Reporterphagen- und Phagen Rezeptorbindeprotein-basierte Detektionsverfahren) entwickelt. |
Welche Bekämpfungsstrategien gibt es? |
|
Überwachung, Aufklärung und Umweltmanagement sind derzeit die grundlegenden Bekämpfungsstrategien der Vermeidung von Pest-Infektionen und der Bekämpfung der Verbreitung des Pest-Erregers. In Endemiegebieten können so mit Hilfe von Ausbruchsüberwachung neu auftretende Infektionen rasch identifiziert werden, um sofortige Gegenmaßnahmen einzuleiten. Grundlegend ist – neben der Aufklärung über die Krankheit – eine Vektorkontrolle mit Bekämpfung der Nagetierpopulation sinnvoll, besonders in urbanen Endemiegebieten. |
Wo liegen zukünftige Herausforderungen? |
|
Eine allgemeine Herausforderung stellt sicherlich die starke Bevölkerungszunahme in Endemiegebieten mit Eingriffen in etablierte Ökosysteme, zunehmender Urbanisierung und die damit einhergehende starke Vermehrung der Nagetierpopulationen (und deren Flöhe) dar. Denkbar ist auch jederzeit ein Import von Y. pestis im Zuge von Migration (aufgrund der schnellen Progressivität der Erkrankung wohl per Flugzeug) in nicht endemische Gebiete. Problematisch bleibt das bisher nur gelegentliche Auftreten von Antibiotika-resistenten Y. pestis-Stämmen. Hier kann eine Zunahme der Inzidenz erwartet werden, auch aufgrund der phylogenetischen Nähe zu relevanten multiresistenten Erregern der Enterobakterien. Wie auch für andere multiresistente Erreger könnte für diesen Fall die Entwicklung alternativer Therapieoptionen, z.B. basierend auf Bakteriophagen, Abhilfe schaffen. |
Weiterführende Informationen |
https://www.who.int/news-room/fact-sheets/detail/plaguehttps://www.cdc.gov/plague/https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Pest.html |
Für die fachliche Unterstützung bei der Erstellung der Steckbriefes zu Yersinis pestis danken wir Dr. Peter Braun, Enrico Mantel und PD Dr. Gregor Grass vom Institut für Mikrobiologie der Bundeswehr in München.
Januar 2023 - Highlights 2022
Jeden Monat veröffentlicht die Zoonosenplattform in der Rubrik Zoonose des Monats den Steckbrief eines zoonotischen Erregers, um einen kleinen Einblick in die spannende und vielfältige Forschung innerhalb der Nationalen Forschungsplattform für Zoonosen zu geben. Im Januar 2023 möchten wir die Rubrik mit einem Rückblick auf die informativen und vielfältigen Steckbriefe aus dem vergangenen Jahr starten.
Für die fachliche Unterstützung bei der Erstellung der Steckbriefe im Jahr 2022 danken wir allen engagierten Forscher:innen aus der Community, die hier ihr Wissen eingebracht haben.
Dezember 2022 - Borrelia burgdorferi sensu lato
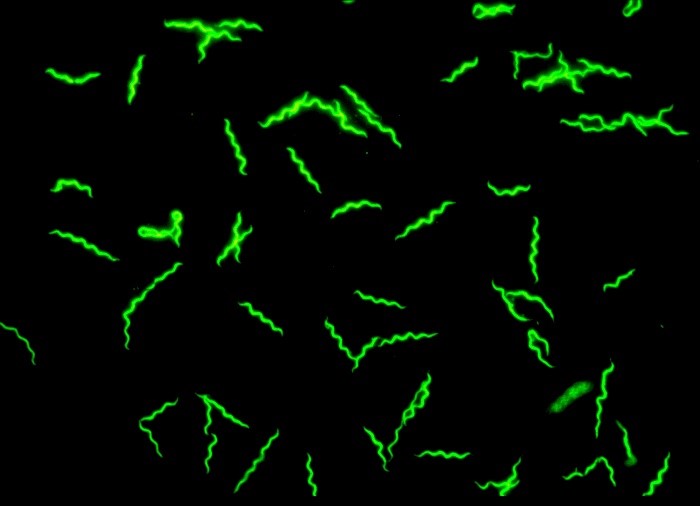
Abb.: Immunfluoreszenzmikroskopie von Borrelia afzelii kultiviert in BSK-H Medium. Länge der Spirochäten: ca. 20 µm. Copyright: Peter Kraiczy, Institut für Medizinische Mikrobiologie und Krankenhaushygiene, Universitätsklinikum Frankfurt
|
Beschreibung |
|
Die Lyme-Borreliose ist eine multisystemische Infektionskrankheit des Menschen und wird durch Spirochäten, die dem Borrelia burgdorferi sensu lato (s.l.; bedeutet „im weiteren Sinn“) Komplex zugehören, verursacht. Sie gehören neben den Treponemen zur Familie der Spirochaetaceae. Diese Gram-negativen Bakterien sind durch ihre unregelmäßig korkenzieherartig geformte Morphologie charakterisiert und besitzen einen Durchmesser von 0,25-0,5 µm und sind 10-30 µm lang. Die im Periplasma lokalisierten Endoflagellen (bis zu 18) verleihen den Borrelien ein hohes Maß an Beweglichkeit. Anhand molekularbiologischer Methoden lassen sich derzeit 21 Genospezies differenzieren, wovon sechs für den Menschen gesichert pathogen sind. Dazu zählen B. burgdorferi sensu stricto (s.s.; bedeutet „im engeren Sinn“), B. garinii, B. bavariensis (früher als B. garinii OspA Serotyp 4 bezeichnet), B. afzelii, B. spielmanii und B. mayonii. Bislang fehlen eindeutige Hinweise für eine Humanpathogenität für die Genospezies B. bissettiae, B. valaisiana und B. lusitaniae. Borrelien besitzen ein im Bakterienreich einmaliges genetisches Repertoire, das aus einem linearen Chromosom von ca. 1 Mbp und etwa 20 zusätzlichen linearen und zirkulären Plasmiden besteht. Die Plasmide unterschieden sich deutlich in Anzahl, Größe und Genloci voneinander und tragen mit ca. 600 kb zum Gesamtgenom bei. |
|
Erstmals entdeckt |
|
In den Jahren 1974/1975 häuften sich in den Orten Lyme und Old Lyme, Connecticut, USA, Fälle von Arthritis bei Kindern – zunächst als juvenile rheumatoide Arthritis fehldiagnostiziert. Der Rheumatologe Allen Steere konnte epidemiologisch den Zusammenhang mit vorausgehenden Zeckenstichen, charakteristischen Hautveränderungen, neurologischen und kardialen Beschwerden sowie jahreszeitlicher Häufung der Hautveränderungen und erhöhten Erkrankungszahlen in waldreichen Gebieten aufzeigen. 1982 gelang Willy Burgdorfer gemeinsam mit Alan Barbour erstmals der Nachweis einer bis dato unbekannten Spirochäte in amerikanischen Schildzecken, die zu einem späteren Zeitpunkt als Ursache verschiedener Entitäten erkannt und schlussendlich als Multisystem-Infektionskrankheit „Lyme Borreliose“ zusammengefasst wurden. |
|
Wo kommt der Erreger vor? |
|
Das geographische Verbreitungsgebiet der Borrelien korreliert mit dem Vorkommen ihres Vektors, vor allem Schildzecken der Gattung Ixodes und erstreckt sich von der gemäßigten Klimazone der nördlichen Hemisphäre Nordamerikas über Europa bis nach Asien (40-60º Grad nördlicher Breite). Bis auf B. mayonii werden alle humanpathogenen Spezies in Deutschland und Europa nachgewiesen während in den USA nur B. burgdorferi s.s. und B. mayonii und in Asien außer B. burgdorferi s.s. und B. mayonii alle anderen o.g. Borrelienspezies vorkommen. Borrelien sind obligat wirtsabhängige Bakterien, die in der Natur in einem enzootischen Zyklus mit verschiedenen Wirbeltierarten als Wirte und Ixodes-Zecken als Vektoren zirkulieren. Zu den Zeckenarten, die als kompetente Vektoren für eine oder mehrere Borrelienspezies fungieren, gehören I. ricinus, I. pacificus, I. persulcatus und I. scapularis, aber auch I. affinis, I. angustus, I. hexagonus, I. minor, I. muris, I. ovatus, und I. spinipalpis. In Deutschland kommen infizierte Zecken in allen Regionen vor, die Inzidenz der Lyme-Borreliose ist jedoch in den südlichen und östlichen Bundesländern am höchsten. |
|
Betroffene Tierspezies, Reservoir |
|
Als Reservoire für Borrelien dienen vor allem Nagetiere, wie z.B. Mäuse, Hamster, Füchse, Kaninchen aber auch Igel oder Vögel, die gleichzeitig mit verschiedenen Borrelienspezies infiziert sein können, jedoch klinisch inapparent sind. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Der Mensch infiziert sich ausschließlich über den Stich einer infizierten Zecke. Eine Übertragung durch andere Vektoren wie z.B. Stechfliegen (z.B. Aedes spp., Ochlerotatus spp.) oder Pferdebremsen erscheint aufgrund des komplexen Übertragungsmechanismus als sehr unwahrscheinlich. In Europa ist die Schildzecke I. ricinus („Gemeiner Holzbock“) der Hauptvektor für die Transmission der Borrelien auf den Menschen. In Abhängigkeit des Verbreitungsgebietes werden Borrelien in Osteuropa und Asien überwiegend von I. persulcatus, in Nordamerika von I. scapularis (Nord- und Südosten der USA) und I. pacificus (Westküste Mittel- und Nordamerikas) übertragen. Für jedes der drei Entwicklungsstadien (Larve, Nymphe, adulte Zecke) benötigen die Zecken jeweils eine Blutmahlzeit, bei der die Spirochäten auf den entsprechenden Wirt übertragen oder im Falle eines bereits infizierten Wirtes von der saugenden Zecke aufgenommen werden. Das Übertragungsrisiko steigt mit zunehmender Dauer des Saugaktes der Zecke, da die Borrelien zunächst aus dem Mitteldarm in die Hämolymphe und final in die Speicheldrüsen einwandern müssen, von wo sie auf den Wirt übertragen werden. Dieser komplexe Vorgang benötigt zumindest einige Stunden. Ergebnisse aus den USA - basierend auf Tierversuchen – weisen auf eine Übertragung frühestens nach 24 h Saugzeit hin, überwiegend jedoch erst nach 48 bis 72 h. Allerdings sind diese Ergebnisse bei anderen Vektoren und anderen Borrelienspezies nicht 1:1 auf die Situation in Europa bzw. Asien übertragbar. Gut konzipierte, systematische Studien aus Europa und Asien zur minimalen Übertragungszeit von verschiedenen Borrelienspezies auf kompetente Wirte, liegen bisher nicht vor. Allerdings lassen einzelne Tierversuche auf eine deutlich frühere Übertragungszeit schließen. Deshalb ist innerhalb der ersten 24 Stunden nach Beginn des Zeckenstich mit einem geringen, jedoch nicht vollständig auszuschließenden Infektionsrisiko zu rechnen. Die Inkubationszeit kann je nach klinischer Symptomatik stark variieren. Für das Erythema migrans liegt sie zwischen 3 und 30 Tagen (Median 7 bis 10 Tage), für andere Manifestationen bei Wochen bis mehrere Monate. Eine Übertragung von Mensch zu Mensch findet nicht statt. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
In Deutschland stellt die Borreliose mit einer jährlichen Inzidenz von 25 bis 100 Fälle pro 100.000 Einwohner (geschätzt 60.000 - 100.000 Neuinfektionen pro Jahr) die häufigste Zecken-übertragene Zooanthroponose dar. Studien zufolge, die sich auf die Auswertung von Krankenkassendaten stützen, könnten sogar über 210.000 Fälle pro Jahr als realistisch angesehen werden. Das potentielle Infektionsrisiko schwankt in Abhängigkeit von der regionalen Durchseuchung der mit Borrelien infizierten Zecken zwischen 10 bis 30%. Das aus verschiedenen Studien ableitbare Risiko einer Infektion nach einem Zeckenstich beträgt etwa 2-6% (Antikörpernachweis), einer klinisch manifesten Erkrankung etwa 1-2%. Nach einem Zeckenstich verläuft bei mehr als 50% der betroffenen Personen die Infektion klinisch inapparent; eine spontane Ausheilung ohne weitere Organmanifestationen lässt sich bei mehr als der Hälfte der Patienten mit einem Erythema migrans beobachten. Durch eine frühe Antibiotikatherapie erkranken heutzutage jedoch weit weniger Patienten an Folgeerkrankungen in Form z.B. einer Lyme-Arthritis oder Neuroborreliose. Chronische Manifestationen (z.B. Acrodermatitis chronica atrophicans) sowie internistische (Karditis) oder ophthalmologische Manifestationen (Chorioretinitis, Konjuktivitis) sind im Vergleich zum Erythema migrans (75%-90% aller Fälle) äußerst selten. Verschiedener Studien zufolge beträgt der „Durchseuchungstiter“ bei gesunden Erwachsenen infolge einer asymptomatisch verlaufenden Infektion etwa 5 bis 25%. Die übliche Einteilung der Lyme-Borreliose in drei unterschiedliche Stadien gilt derzeit als überholt, insbesondere da die Lyme-Borreliose mit jeder Manifestation beginnen kann. Aus diesem Grund ist es praxisrelevanter, die klinischen Symptome einer frühen und einer späten Phase zuzuordnen. Zur Frühphase – Tage bis Wochen nach dem Zeckenstich - zählt das klassische Erythema migrans, multiple Erythemata migrantia, das Borrelien-Lymphozytom, die Meningopolyneuritis (Bannwarth-Syndrom), Meningitis (v.a. bei Kindern), die Perimyokarditis oder die Konjunktivitis (beides sehr selten vorkommend). Begleitend kann ein allgemeines Krankheitsgefühl mit u.a. subfebrilen Temperaturen, Kopfschmerzen oder Gliederschmerzen auftreten; jedoch keine respiratorischen oder gastrointestinalen Symptome. Wochen bis viele Monate nach erfolgtem Zeckenstich können sich späte (früher als „chronisch“ bezeichnete) Manifestationen zeigen: Eine Acrodermatitis chronica atrophicans, späte Neuroborreliose (Meningitis, Enzephalitis, Enzephalomyelitis), Lyme-Arthritis oder extrem selten eine Vaskulitis. Durch die saisonale Aktivität der Zecken zeigt sich eine jahreszeitliche Häufung der frühen Symptome bevorzugt zwischen April und Oktober; bei milden Temperaturen in den Wintermonaten kann es jedoch ebenfalls zum Auftreten von Frühmanifestationen kommen. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Die Therapie einer gesicherten Lyme-Borreliose erfolgt möglichst frühzeitig jedoch nicht prophylaktisch mit einem geeigneten Antibiotikum. Als Mittel der 1. Wahl eignen sich Doxycyclin (200 mg/ Tag) und Amoxicillin (3x 500-1000 mg/ Tag). Orale Alternativen sind Cefuroximaxetil, Penicillin V und Azithromycin, intravenös kann Ceftriaxon, Cefotaxim oder Penicillin G verabreicht werden. Die Therapiedauer orientiert sich nach Art, Dauer und Schwere der klinischen Symptomatik (Früh- oder Spätphase) und dem eingesetzten Antibiotikum. Das Erythema migrans wird 10-14 Tage behandelt, früh disseminierte Formen 14-21 Tage und späte Erkrankungsformen 30 Tage. Für die Neuroborreliose eignen sich Doxycyclin, Ceftriaxon, Cefotaxim oder Penicillin G zur Therapie, die 14 Tage bei einer frühen und 14-21 Tage bei einer späten Neuroborreliose verabreicht werden. Die Prognose für infizierte Personen ist in aller Regel gut; häufig heilt die Lyme-Borreliose spontan oder nach erfolgter antibiotischer Therapie aus. Schwere oder chronische Verläufe verbunden mit zum Teil irreversiblen Organdefekten stellen eher die Ausnahme dar. In seltenen Fällen kommt es zur einer Antibiotika-refraktären, immunologisch-mediierten chronischen Lyme-Arthritis, die symptomatisch therapiert wird. In Zusammenarbeit mit der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) wurden für die kutane Lyme-Borreliose (Federführend: Deutsche dermatologische Gesellschaft) eine S2k- sowie für die Neuroborreliose (Federführend: Deutsche Gesellschaft für Neurologie) eine S3-Leitlinie erarbeitet. In den USA wurde 1998 ein, auf dem Oberflächenprotein OspA von B. burgdorferi s.s. basierender Impfstoff (Lymerix) zugelassen, der 2002 vom amerikanischen Markt genommen wurde. Die hohe Heterogenität von OspA und OspC, das ebenfalls als weiteres Antigen ins Visier genommen wurde, machten die Weiterentwicklung, einer für den europäischen und asiatischen Markt interessanten Vakzine zu einer besonderen Herausforderung. Derzeit hat ein rekombinanter, polyvalenter Impfstoff auf der Basis von sechs verschiedenen OspA-Serotypen die Phase II erfolgreich absolviert. Mit einer Markteinführung wird ab 2025 zu rechnen sein. Die prophylaktischen Maßnahmen beschränken sich maßgeblich auf die Minimierung des Zeckenstichrisikos und die frühzeitige Entfernung saugender Zecken. Eine körperbedeckende Kleidung sowie Vermeidung von zeckendurchseuchten Gebieten und Auftragen von Repellentien auf unbedeckte Haut und Kleidung kann das Zeckenstich-Risiko deutlich reduzieren. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Die epidemiologische Datenlage für Deutschland ist lückenhaft und unzureichend, u.a. da keine bundesweite krankheits- oder erregerspezifische Meldepflicht gemäß IfSG besteht. Die zur Verfügung stehenden Daten basieren auf einer länderspezifischen Meldepflicht aus derzeit neun Bundesländern (Bayern, Berlin, Brandenburg, Mecklenburg-Vorpommern, Rheinland-Pfalz, Saarland, Sachsen, Sachsen-Anhalt und Thüringen). |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Die Schwerpunkte/ Fragen in der aktuellen Forschung zu Borrelien und Lyme-Borreliose sind:
|
|
Welche Bekämpfungsstrategien gibt es? |
|
Relevante, breit einsetzbare Strategien zur Bekämpfung stehen keine zur Verfügung, nicht zuletzt wegen des breiten Vorkommens der Zecken und ihres sehr breiten Spektrums von möglichen Wirtstieren. |
|
Wo liegen zukünftige Herausforderungen? |
|
Eine sachlich-geführte Aufklärung über das Krankheitsbild, Therapie und einer zielführenden Diagnostik durch verschiedene Medien kann einen wichtigen Beitrag liefern, um nicht zu empfehlende diagnostische und therapeutische Interventionen zu vermeiden. Zudem sollten Zecken-übertragene Zoonosen im Ausbildungscurriculum klinisch tätiger Ärzte mehr Aufmerksamkeit geschenkt werden. Derzeit ist die Auswirkung des Klimawandels und der Renaturierung von Ökosystemen zur Steigerung der Biodiversität auf die Zunahme und für die Verbreitung von Zeckenpopulationen und ihrer natürlichen Wirte sowie des damit einhergehenden Risikos zunehmender Infektionen nur schwer einzuschätzen. Daher ist ein breit angelegtes, longitudinales Monitoring der Epidemiologie von Zeckenpopulationen als sinnvoll zu erachten. |
|
Sonstiges |
|
Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit: https://www.lgl.bayern.de/gesundheit/infektionsschutz/infektionskrankheiten_a_z/borreliose/index.htm BZgA: www.infektionsschutz.de/erregersteckbriefe/borreliose/ |
Für die fachliche Unterstützung bei der Erstellung des Borrelia burgdorferi -Steckbriefes danken wir Prof. Dr. Peter Kraiczy vom Institut für Medizinische Mikrobiologie und Krankenhaushygiene, Universitätsklinikum Frankfurt und Dr. Volker Fingerle vom Bayrisches Landesamt für Gesundheit und Lebensmittelsicherheit, Oberschleißheim.
Oktober 2022 - Chikungunya-Virus
Abb.: Leberzellen, die mit rot fluoreszierendem Chikungunya-Virus (CHIKV E2-mCherry) infiziert sind. Zellkerne sind in blau gezeigt, dsRNA in grün. Maßstab: 10µm. Copyright: Lisa Lasswitz
|
Beschreibung |
|
Das Chikungunya-Virus (CHIKV) ist ein umhülltes Virus das zur Familie der Togaviren, Gattung Alphaviren gehört. Das ca. 12 Kilobasen große Genom liegt in Positiv-Strang Orientierung (+ssRNA) vor und ähnelt mit seinen Modifikationen (3’Cap und 5’polyA) zellulären mRNAs. Es codiert für zwei Polyproteine, eines für die Nicht-Strukturproteine nsp1-4 und eines, das die Strukturproteine C (Capsid), E1, E2, E3 (Envelope 1-3) und 6k enthält, welche proteolytisch in die Einzelproteine gespalten werden. In der initialen Replikationsphase werden die für die Replikation notwendigen Nicht-Strukturproteine gebildet. Daraufhin wird das Genom in membranösen Strukturen, sogenannten Spherules, an der Plasmamembran der Wirtszelle durch die virale RNA-abhängige RNA Polymerase nsP4 repliziert. Von den neugebildeten Genomen wird dann der für die Strukturproteine codierende Teil abgelesen, um große Mengen Strukturproteine für die Bildung der neuen Viren zu produzieren. CHIKV ist der bekannteste Vertreter der arthritogenen Alphaviren, die Gelenkentzündungen auslösen. Innerhalb der Alphaviren ist das O’nyong-nyong-Virus welches auch ähnliche Krankheitsverläufe verursacht am nächsten mit CHIKV verwandt. Die Hauptvektoren von CHIKV, sowohl im enzootischen als auch im epidemischen Kreislauf, sind Mücken der Gattung Aedes. Für die Übertragung auf den Menschen sind primär die Spezies Aedes aegypti (Gelbfiebermücke) und Aedes albopictus (Asiatische Tigermücke) verantwortlich. |
|
Erstmals entdeckt |
|
Es wird vermutet, dass das Chikungunya-Virus schon seit Jahrhunderten in Afrika vor allem zwischen Primaten und silvatischen Mückenspezies zirkuliert und bei gelegentlicher Übertragung auf den Menschen auch Epidemien verursacht. Der erste CHIKV Ausbruch, der wissenschaftlich dokumentiert wurde, war im Jahr 1952 im heutigen Tansania. In diesem Kontext wurde CHIKV zum ersten Mal isoliert und beschrieben. Der Name Chikungunya stammt von einem deskriptiven Ausdruck in der Stammesprache der Makonde, der „der gekrümmt Gehende“ bedeutet und damit die sehr schmerzhafte Symptomatik der Erkrankung beschreibt. |
|
Wo kommt der Erreger vor? |
|
Heute ist CHIKV in Afrika, Asien, Europa, sowie Nord- und Südamerika verbreitet. In Afrika herrschen zwei Subtypen vor, die Westafrikanische CHIKV Linie sowie die epidemiologisch noch bedeutsamere Ost-Zentral-Südafrikanische Linie (East-Central-South African, ECSA). Seit den 1960er Jahren werden immer wieder Epidemien in verschiedenen Regionen Asiens beschrieben. Dort findet sich sowohl die ursprünglich dort etablierte ECSA Variante, sowie deren Nachfolger, die Asiatische Linie. Seit 2013 kommt es zudem zu Ausbrüchen in Süd- und Nordamerika, die sowohl von der Asiatischen Linie als auch durch die ECSA Linie ausgelöst werden. Im Jahr 2004 wurde ein neuer CHIKV Stamm in Kenia entdeckt, wieder ein Abkömmling der ECSA Linie. Im Folgejahr verursachte der gleiche Stamm große Ausbrüche auf verschiedenen Inseln des Indischen Ozeans, weshalb er als Indian Ocean Lineage (IOL) bezeichnet wird. Besonders gut untersucht wurde ein Ausbruch auf der französischen Insel La Réunion, der ein Drittel der Bevölkerung betraf. Auf La Réunion finden sich kaum Aedes aegypti Mücken, sondern primär Aedes albopictus, welche zuvor nicht als relevante Überträger von CHIKV bekannt waren. Sequenzanalysen und darauffolgende molekularbiologische Untersuchungen haben gezeigt, dass der auf La Réunion aufgetretene Stamm genetische Anpassungen, allen voran eine Alanin-zu-Valin Substitution (A226V) im Hüllprotein E1 aufweist, welche eine 40-100fache Erhöhung der Infektionsrate in Aedes albopictus verursacht. Dieser neue CHIKV Stamm vergrößert damit substanziell das Risiko von Epidemien in Gebieten, die zuvor durch die Abwesenheit von Aedes aegypti relativ geschützt waren. Auch auf dem europäischen Festland ist CHIKV etabliert, vor allem rund um das Mittelmehr, wo auch Aedes albopictus häufig vorkommt. Insgesamt wurde CHIKV bereits in 11 europäischen Ländern nachgewiesen. In Italien und Frankreich ist es seit 2007 immer wieder zu autochthonen (einheimischen) Ausbrüchen gekommen. |
|
Betroffene Tierspezies, Reservoir |
|
In ländlichen Gebieten Afrikas zirkuliert CHIKV zwischen silvatischen Mücken (z.B. Aedes africans) und Primaten. Auch Nagetiere können infiziert sein und könnten somit als Virusreservoir dienen. Epidemiologisch ist jedoch primär der Mensch als Reservoir bedeutsam, da große Ausbrüche hauptsächlich in urbanen Gegenden auftreten. Dort herrschen Aedes aegypti und Aedes albopictus Mücken vor, welche bevorzugt Menschen stechen und somit das Virus von Mensch zu Mensch übertragen. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Zu einer Infektion kann es kommen, wenn eine Person von einer mit CHIKV infizierten Mücke gestochen wird. Ist die Mücke infiziert, so repliziert das Virus auch in den Speicheldrüsen, von wo aus es mit dem Mückenspeichel in die Haut des nächsten Wirtes eingebracht wird. Ein besonderes Risiko besteht also für Menschen, die sich in Gebieten aufhalten, in denen eine der beiden Hauptvektorspezies (Aedes aegypti, Aedes albopictus) häufig vorkommt und in denen CHIKV zirkuliert. Das Infektionsrisiko ist saisonal verschieden. Ein erhöhtes Risiko besteht während der Brutzeit der Mücken, da die Weibchen für die Eiablage eine Blutmahlzeit benötigen. Dies geschieht vor allem bei hohen Temperaturen nach Regenfällen, wenn viele stehende Gewässer für die Eiablage verfügbar sind. Die Mücken sind dann vor allem während der Dämmerung auf Nahrungssuche. Aedes aegypti lebt in tropischen und subtropischen Gegenden. Aedes albopictus ist hingegen besser an gemäßigtes Klima mit kalten Wintern angepasst. In Deutschland finden sich etablierte Kolonien von Aedes albopictus vor allem im südlichen Rheintal. Neueste Daten aus dem Mückenatlas zeigen, dass eine Etablierung von neuen Albopictus-Kolonien jedoch auch viel weiter nördlich wahrscheinlich ist. In diesem Zusammenhang wurden in Berlin bereits Hinweise auf eine erfolgreiche Überwinterung von Aedes albopictus gefunden. Bisher ist keine autochthone Übertragung von CHIKV in Deutschland dokumentiert. Alle bisherigen Fälle waren mit Reisen in Endemiegebieten assoziiert. Zusätzlich zu der Übertragung durch Stechmücken, kann CHIKV durch Blutkontakt übertragen werden beispielweise durch Nadelstichverletzungen von klinischem Personal nach Blutabnahme von infizierten Patienten. Eine Übertragung von Müttern auf den Embryo wurde im zweiten Trimester beobachtet. Auch kann es zu einer Übertragung auf Neugeborene während des Geburtsvorgangs kommen, wenn die Mutter zum Zeitpunkt der Geburt virämisch ist. Muttermilch und somit das Stillen stellen nach jetzigem Wissensstand kein Übertragungsrisiko dar. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Beim Menschen beträgt die mittlere Inkubationszeit 3 bis 7 Tage. Neben plötzlich auftretendem Fieber, Kopfschmerzen und fleckig-knotigem Hautausschlag sind vor allem starke Muskelschmerzen sowie symmetrisch auftretende schwere Gelenksschmerzen die Hauptsymptome einer CHIKV Infektion. In ungefähr der Hälfte aller Fälle bleiben die der rheumatoiden Arthritis ähnelnden Gelenkschmerzen für Monate bestehen. Neben diesen stark einschränkenden arthritischen Symptomen wurde auch eine Verstärkung bereits vorhandener Erkrankungen beobachtet. Vor allem bei älteren Menschen kann die Erkrankung tödlich verlaufen. Insgesamt ist die durch CHIKV verursachte Sterblichkeit mit ca. 0.1% zwar gering, aber aufgrund des hohen Übertragungspotentials nicht zu vernachlässigen. Ungefähr 20-40% der Infizierten bleiben symptomfrei. Es wird davon ausgegangen, dass eine durchgemachte Infektion lebenslange Immunität vermittelt. Die Symptome in Primaten sind denen des Menschen sehr ähnlich. Es kommt ebenso zu Fieber und Muskel- bzw. Gelenkbeschwerden. Dahingegen ist die natürliche CHIKV-Infektion bei ausgewachsenen Mäusen weitestgehend asymptomatisch und wird immunologisch schnell geklärt. In C57BL/6 Mäusen können jedoch die Muskel- und Gelenksymptome durch Injektion des Virus in die Pfote nachgeahmt werden. Es kommt zu Schwellungen des injizierten Gewebes und zu Entzündungen der Gelenke, jedoch bleibt beides, anders als im Menschen, lokal begrenzt. Für Wirksamkeitsstudien antiviraler Ansätze werden darüber hinaus neugeborene Mäuse verwendet, die sehr schnell tödliche Hirnhautentzündungen entwickeln, oder adulte immungeschwächte Mäuse, denen der Typ I Interferonrezeptor fehlt und bei denen die Infektion ebenfalls zum Tod führt. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Eine Therapie des Chikungunya-Fiebers erfolgt ausschließlich symptomatisch, primär mit fiebersenkenden und schmerzlindernden Medikamenten. Bisher konnte keine der spezifischen antiviralen Substanzen, die untersucht wurden, in klinischen Tests bestehen. Eine zeitnahe Entwicklung eines antiviral wirksamen Präparats ist daher nicht abzusehen. Es werden jedoch eine Vielzahl verschiedener Impfstoffe in klinischen Studien untersucht und eine baldige Entwicklung einer zumindest im Epidemiefall einsetzbaren Vakzine scheint möglich. Unter den in Phase II und III getesteten Präparaten findet sich eine breite Sammlung verschiedener Ansätze. Getestet werden abgeschwächte Lebendimpfstoffe, inaktivierte Viren, sowie virusähnliche, nicht-replikationskompetente Impfstoffe und ein rekombinantes Virus auf der Basis eines Masernimpfstoffes. Erste Studien testen auch mRNA-basierte Immunisierungen, zum Beispiel wird die Wirksamkeit des für die Strukturproteine kodierenden Subgenoms von CHIKV für eine aktive Immunisierung untersucht. Besonders erfolgversprechend, vor allem für den schnellen Einsatz bei Epidemien auch in wirtschaftsschwachen Regionen, erscheint zu diesem Zeitpunkt ein Lebendimpfstoff, welcher durch gezielte Mutation des Nicht-Strukturproteins 3 attenuiert wurde. Dieser Impfstoff induziert eine über mehrere Monate anhaltende Antikörperantwort, welche in ersten Studien gegen alle bekannten Virusvarianten wirksam war. Momentan werden klinische Phase III-Studien in Brasilien durchgeführt, wo es in den letzten Jahren immer wieder zu großen CHIKV Ausbrüchen gekommen ist. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
In Deutschland ist jede durch Neutralisationsassays, Serokonversion oder qPCR nachgewiesene CHIKV-Infektion meldepflichtig. Eine klinische Meldepflicht besteht jedoch nur im Fall eines hämorrhagischen Fiebers, welches bei CHIKV selten auftritt. Zusätzlich gibt es verschiedene Ansätze zur Überwachung der Vektorspezies. Im Rheintal, wo auch die Asiatische Tigermücke etabliert ist, wird die Ausbreitung verschiedener Mückenspezies aktiv überwacht. Bundesweit beteiligen sich Bürger am Projekt Mückenatlas, mit dem das Vorkommen verschiedener Mückenspezies kartiert und überwacht wird. Da in Deutschland bisher noch keine lokalen Übertragungen mit CHIKV dokumentiert wurden, gibt es bisher keine flächendeckende Testung von Aedes albopictus auf CHIKV Infektion. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Eine besonders auch für die Therapie- und Impfstoffentwicklung bedeutende Frage dreht sich um den Pathogenesemechanismus der chronischen CHIKV-Arthritis. Zum jetzigen Zeitpunkt ist noch unklar, ob es sich dabei primär um eine Folge der starken Immunantwort handelt, oder ob eine persistierende Infektion zugrunde liegt. Neuere Studien deuten an, dass virale RNA in den Gelenken für lange Zeit verbleiben und damit zu einer langanhaltenden Immunstimulation führen könnte. Weitere Studien an geeigneten Infektionsmodellen, wie primären Gelenkszellen oder im Tiermodel, sind unbedingt erforderlich, um gezielt Strategien gegen die langanhaltenden und folgenreichen Gelenkbeschwerden zu entwickeln. Ein weiterer Forschungsschwerpunkt ist die Entwicklung neuer Ansätze, die nicht auf die Reduktion der Vektorpopulationen abzielen, sondern darauf, die Replikation humanpathogener Viren in den Vektorspezies zu reduzieren. Ein bekanntes Beispiel für diese Strategie ist die gezielte Infektion von Aedes aegypti mit Wolbachia-Bakterien, welche vermutlich durch Competition die Replikation verschiedener Viren in den Mücken verringern. Eine geringere Replikation in der Mücke verringert die Viruslast im Speichel und somit das Infektionsrisiko für Menschen. Im Rahmen einer ähnlichen Strategie wird untersucht, wie sich Infektion der Stechmücken mit insektenspezifischen und somit für den Menschen unbedenklichen Viren auf die Transmissionsfähigkeit von CHIKV und anderen humanpathogenen Viren auswirkt. Die Identifizierung von Wirtsfaktoren sowohl in Stechmücken als auch im Menschen ist ein weiterer Forschungsschwerpunkt. Ziel dieser Arbeiten ist es, essenzielle Schritte im Replikationszyklus zu identifizieren, welche durch antivirale Strategien angegriffen werden können. Vor allem die Identifikation von Virus-Wirt Interaktionen in Aedes ist therapeutisch interessant. Die Idee hierbei ist, dass es besonders vorteilhaft wäre, antivirale Substanzen zu finden, die gezielt auf die Infektion der Vektoren wirkt, und es möglicherweise erlauben würde, das Virus zu hemmen bevor es den Menschen erreicht. Die Vektorkompetenz und die Speziesspezifität des CHIKV sind zudem bedeutende Fragen, um vorherzusagen, ob sich das Virus in weitere geographische Regionen ausbreiten kann. Die Anpassungsfähigkeit des CHIKV an Aedes albopictus legt nahe, dass eine effiziente Vermehrung in weiteren Stechmückenarten möglich sein könnte. Beispielsweise wurde CHIKV bereits während eines Ausbruchs in Brasilien in Culex quinquefasciatus Stechmücken gefunden und erste experimentelle Daten haben gezeigt, dass diese Art CHIKV übertragen könnte. In Aedes albopictus konnte CHIKV ebenfalls schon vor dem Aufkommen der Indian Ocean Linie replizieren, die Mutationen haben die Replikationsfähigkeit lediglich erhöht. Ob das Virus eine vollkommen neue Stechmückenart infizieren kann, ist unklar und eher unwahrscheinlich. Bezüglich möglicher Tierreservoire des CHIKV und der Verbreitung dieser Reservoire liegen derzeit unzureichende Daten vor. Da virale RNA und Antikörper wiederholt in Primaten gefunden wurden, wird davon ausgegangen, dass Primaten das Hauptreservoir darstellen. Vereinzelt wurden auch Antikörper in Nagern gefunden. Experimentell sind sogar einige Reptilien und Amphibien empfänglich für das Virus. Jedoch bevorzugen die relevanten Mückenarten Menschen und stechen diese Tierarten typischerweise nicht. Daher ist derzeit nicht von einer Etablierung des Virus in anderen Tierreservoiren als Primaten auszugehen. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Da bisher noch kein Impfstoff verfügbar ist, sind Strategien zur Expositionsprophylaxe essenziell. Auf Landesebene liegt der Fokus hierbei auf der Bekämpfung der Vektorspezies. Da Mücken der Gattung Aedes nicht nur CHIKV, sondern auch andere Viruskrankheiten wie Gelbfieber, Dengue und Zika übertragen, ist die Eindämmung der Aedes Populationen von herausragender Bedeutung. Hierfür kommen Insektizide und Biozide zum Teil großflächig zum Einsatz. Neuere Strategien setzten auf das Einbringen von vermehrungsunfähigen Männchen in die Population. Auf diese Weise wird die Anzahl der Nachkommen verringert. Um die Sterilität der Männchen zu erreichen, werden sowohl Inaktivierungsmethoden wie auch genetische Ansätze getestet. In Europa wird ein Einsatz genetisch veränderter Mücken bisher nur unter Laborbedingungen getestet. Im Feld liegt der Fokus darauf, neu etablierende Stechmücken Populationen durch den gezielten Einsatz von Insektiziden auszurotten sowie ein enges Überwachungsnetz zu spannen, das es erlaubt, die Populationsgröße von Aedes albopictus an verschiedenen Standorten zu überwachen und gezielt Insektizide, Larvizide oder natürliche Fressfeinde einzusetzen. Auf individueller Ebene ist die wichtigste Präventionsmaßnahme das Vermeiden von Mückenstichen. Dies gilt vor allem in Ländern in denen CHIKV Ausbrüche bereits dokumentiert sind (zu finden beispielsweise unter www.CDC.gov/Chikungunya). Methoden hierfür beinhalten das Tragen langer Kleidung, das Auftragen von Mückenabwehrmitteln auf Kleidung und Haut, die Verwendung von Mückennetzen, sowie das Vermeiden von Aktivitäten im Freien bei Dämmerung. |
|
Wo liegen zukünftige Herausforderungen? |
|
Im Zusammenhang mit dem intensiven Einsatz von Insektiziden kommt es auch vermehrt zur Entwicklung von Resistenzen bei den Vektorspezies. Daher ist es besonders wichtig, den Einsatz verschiedener Substanzen (Insektizide, Larvizide, Biozide) zu koordinieren und Resistenzentwicklungen zu überwachen. Darüber hinaus sollte auch die Entwicklung neuer Substanzen und anderer Bekämpfungsstrategien (s.o.) weiter vorangetrieben werden. Aedes albopictus breitet sich immer weiter in gemäßigten Klimazonen aus. Durch die Klimaveränderungen scheint es den Mücken zunehmend möglich in Nordeuropa stabile Populationen zu etablieren. Es ist daher zu befürchten, dass es vermehrt zu CHIKV Epidemien in Gebieten mit immun-naiver Bevölkerung kommen wird. Auch in Deutschland ist es wohl nur eine Frage der Zeit, bis es zu ersten CHIKV Ausbrüchen kommt. Konzertierte, groß angelegte staatliche Maßnahmen sowie eine aktive Sensibilisierung der Bevölkerung für die Problematik ist nötig, um dies so lange wie möglich zu verhindern und im Fall eines Ausbruchs die Auswirkungen so gering wie möglich zu halten. Eine erfolgreiche Eindämmung von Aedes albopictus wird nur gelingen, wenn die Bevölkerung aktiv informiert wird und bei der Beseitigung von Brutstätten mithilft. Für den zu erwartenden Fall, dass es zu einer Einschleppung von CHIKV durch Reisende kommt, ist es besonders wichtig, Hausärzte entsprechend vorzubereiten, insbesondere, wenn die infizierte Person in einem Gebiet mit Aedes albopictus Populationen lebt. Infizierte sollten unbedingt darüber informiert werden, wie wichtig es ist, dass sie es vermeiden erneut gestochen zu werden, um eine Ausbreitung zu verhindern. So kann es gelingen, CHIKV Ausbrüche auch in Zukunft zu verhindern. Besonders in Deutschland, wo der Altersdurchschnitt hoch ist, besteht ein erhöhtes Risiko schwerwiegender Folgen durch einen unkontrollierten CHIKV Ausbruch. |
Für die fachliche Unterstützung bei der Erstellung des Chikungunya-Virus-Steckbriefes danken wir Dr. Cora Stegmann, Dr. Lisa Lasswitz und Prof. Dr. Gisa Gerold vom Institut für Biochemie und Research Center for Emerging Infections and Zoonoses (RIZ) an der Tierärztlichen Hochschule Hannover.
September 2022 - Bourbon-Virus
Abb.: Elektronenmikroskopische Aufnahmen von Bourbon-Virus Partikeln. Der Pfeil zeigt auf die runde, kopfartige Struktur die bei filamentösen Viruspartikeln zu beobachten ist. (Abb. entnommen aus Fuchs et al., Journal of Virology, 2022)
|
Beschreibung |
|
Das Bourbon-Virus (BRBV, Thogotovirus bourbonense) ist ein zeckenübertragenes Orthomyxovirus der Gattung Thogotovirus. Es ist ein behülltes Virus mit einem Genom aus sechs Segmenten einzelsträngiger RNA negativer Polarität. Es ist das einzige bekannte Thogotovirus, welches auf dem nordamerikanischen Kontinent zu humanen Krankheitsfällen geführt hat. Verwandte Thogotoviren sind sporadisch mit humanen Infektionen assoziiert und können eine fiebrige Erkrankung sowie Fehlgeburten in Nutztieren hervorrufen (Filipe et al., 1986). |
|
Erstmals entdeckt |
|
Das Bourbon-Virus wurde 2014 erstmals aus einem Patienten mit einer schweren fiebrigen Erkrankung nach mehreren Zeckenbissen in Bourbon County, Kansas, USA isoliert (Kosoy et al., 2015). Da serologische Tests auf bekannte zeckenübertragene Krankheiten in der Region wie das Rocky-Mountain-Fleckfieber, Lyme-Borreliose oder Ehrlichiose negativ ausfielen und eine antibiotische Therapie zu keiner Besserung führte, wurden Vero-Zellen mit Serumproben des Patienten inokuliert – und es konnte ein zytopathischer Effekt beobachtet werden. Der isolierte Erreger wurde elektronenmikroskopisch untersucht und anhand seiner Morphologie als Orthomyxovirus identifiziert. Durch Next-Generation Sequencing konnte das Bourbon-Virus den Dhori-ähnlichen Thogotoviren zugeordnet werden. |
|
Wo kommt der Erreger vor? |
|
Bourbon-Virus wurde bislang ausschließlich im mittleren Westen der USA gefunden. Es wurden bei epidemiologischen Feldstudien mehrere Isolate aus Zecken der Spezies Amblyomma americanum gewonnen, welche in den Bundesstaaten Missouri, Kansas und Oklahoma gesammelt wurden (Jackson et al., 2019; Savage et al., 2017, 2018). Bourbon-Virus-neutralisierende Antikörper wurden in einem breiten Spektrum an wilden und domestizierten Tieren sowie in Menschen in Missouri und North Carolina nachgewiesen. Das bisher bekannte Verbreitungsgebiet von Bourbon-Virus korreliert mit der Verbreitung des Vektors A. americanum, welche auf den südöstlichen Teil Nordamerikas begrenzt ist. Vor Kurzem wurde Bourbon-Virus erstmals in Virginia, in der in Nordamerika invasiven Zeckenart Haemaphysalis longicoris nachgewiesen (Cumbie et al., 2022). Dadurch vergrößert sich das potenzielle Verbreitungsgebiet von Bourbon-Virus erheblich. |
|
Betroffene Tierspezies, Reservoir |
|
Weißwedelhirsche (white tailed deer, Odocoileus virginianus) und Waschbären (Procyon lotor) stellen die wahrscheinlichsten Reservoirspezies für BRBV dar, da sie in serologischen Studien die höchsten Prävalenzen (bis zu 86% bei Weißwedelhirschen) aufwiesen (Jackson et al., 2019; Komar et al., 2020). Auch in domestizierten Pferden und Hunden konnten Bourbon-Virus-reaktive Antikörper nachgewiesen werden. Wie bei anderen Arboviren könnten auch kleine Säugetiere wie Nager eine Rolle als Reservoir spielen. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Menschen können sich durch Bisse infizierter Zecken mit BRBV infizieren. Andere Übertragungswege und Mensch-zu-Mensch Übertragung wurden bisher nicht nachgewiesen. Eine Übertragung über Aerosole wurde im Rahmen eines Laborunfalls für das verwandte Dhori-Thogotovirus (Thogotovirus dhoriense) berichtet (Butenko et al., 1987). Studien im Mausmodell konnten bisher keine Übertragungen durch nahen Kontakt zeigen (Fuchs et al, 2022). Eine Mensch-zu-Mensch Übertragung von Bourbon-Virus ist daher unwahrscheinlich, kann jedoch nicht vollends ausgeschlossen werden. Menschen, die sich viel in der Natur aufhalten, haben durch ihre erhöhte Exposition gegenüber Zecken in den endemischen Gebieten ein erhöhtes Risiko sich mit BRBV zu infizieren. Studien zu speziellen Risikogruppen (z. Bsp. Forstarbeiter, Landwirte) gibt es bislang aber nicht. Da in einer kürzlich veröffentlichten Studie mit humanen Seren aus Missouri (Bamunuarachchi et al., 2022) eine relativ hohe Seroprevalenz für Bourbon-Virus-spezifische Antikörper nachgewiesen wurde, liegt es nahe, dass die relativ seltenen mit Bourbon-Virus assoziierten, schweren humanen Krankheitsverläufe durch einen unerkannten Defekt im angeborenen Immunsystem der Patienten begünstigt wurden. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Es gibt bisher wenige dokumentierte humane Krankheitsfälle im Zuge einer BRBV Infektion. Der erste bekannte Fall war ein >50 jähriger männlicher Patient, welcher nach mehrfachen Zeckenbissen eine Reihe teils grippeähnlicher Symptome (Übelkeit, Schwächegefühl, Durchfall gefolgt von Fieber, Kopf- und Muskel- und Gelenkschmerzen, Schüttelfrost, Appetitlosigkeit) entwickelte und zudem einen papulösen Ausschlag („papular rash“) am Torso aufwies (Kosoy et al., 2015). Zudem wurden eine Leukopenie und Thrombopenie festgestellt, während erhöhte Leberwerte auf eine akute Hepatitis hinwiesen. Nach 11-tägiger Krankheit starb der Patient an Herzstillstand in Folge eines Multiorganversagens. Ein weiterer Patient wies 2015 während einer Krankheit mit nicht näher spezifizierten Symptomen neutralisierende Antikörper gegen Bourbon-Virus auf, überlebte aber die Erkrankung (Savage et al., 2017). 2017 kam es zu einem weiteren Todesfall im Zusammenhang mit einer Bourbon-Virus Infektion bei einer 58-jährigen Patientin, welche mit ähnlichen Symptomen wie im ersten Fall nach 23-tägiger Krankheit verstarb (Bricker et al., 2019). Die Inkubationszeit kann anhand des zeitlichen Abstands zwischen den Zeckenbissen und dem Symptombeginn auf etwa eine Woche geschätzt werden. Im Mausmodell führt eine Bourbon-Virus-Infektion zu keinerlei Krankheitssymptomen. Wenn bei den Experimenten jedoch Tiere mit einem Defekt im Typ I und II Interferonsystem verwendet wurden, führte die Infektion zu einer symptomatischen, systemischen Erkrankung, die den humanen Fällen ähnelt (Fuchs et al., 2019, Bricker 2019). |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Weder für Bourbon-Virus noch für andere Thogotoviren gibt es zugelassene Impfstoffe. Als Therapieansatz wurden die bereits verfügbaren antiviralen Wirkstoffen Favipiravir und Ribavirin im Mausmodell erfolgreich getestet (Bricker et al., 2019; Fuchs et al., 2019). Beide Stoffe hemmen die virale RNA-abhängige RNA-Polymerase und sind gegen ein breites Spektrum von RNA-Viren wirksam. Zellkulturexperimente geben Hinweise darauf, dass eine zusätzliche Gabe von Interferon (IFN-α) zur Ergänzung der Therapie eingesetzt werden könnte. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Ein dediziertes Überwachungssystem für Bourbon-Virus existiert nicht. Vereinzelte serologische Studien bei Menschen und Tieren sowie das Screening von in Feldstudien gesammelten Zecken geben aber Hinweise über das Verbreitungsgebiet von Bourbon-Virus und die Häufigkeit von Infektionen. Bei den zeckenübertragenen Krankheitserregern in den USA spielt Bourbon-Virus bisher nur eine untergeordnete Rolle und wird somit auch nicht routinemäßig diagnostiziert. In den endemischen Gebieten sind die bakteriellen Erreger des Rocky-Mountain-Fleckfiebers (Rickettsien), der Lyme-Borreliose (Borrelien) oder der Ehrlichiose (Ehrlichia und Anaplasma) und das Heartland-Virus (HRTV, Phenuiviridae) von größerer medizinischer Bedeutung. Ein Monitoring von Zecken auf diese und weitere virale Erreger könnte daher ein sinnvolles Überwachungssystem darstellen. Ein direkter Nachweis des BRBV mittels RT-PCR-Diagnostik ist möglich. Ebenso existieren Testsysteme für die Serodiagnostik (Bamunuarachchi et al., 2022). Das US-CDC bietet eine Testung an (https://www.cdc.gov/bourbon-virus/healthcareproviders/index.html ), aber kommerzielle Tests sind nicht verfügbar. Weder BRBV noch HRTV sind derzeit in den USA meldepflichtig („notifiable disease“). |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
Zurzeit untersuchen wir intensiv die Molekularbiologie dieser Viren mit einem Fokus auf der Suche nach noch unbekannten zusätzlichen Genprodukten, die die unerwartete IFN-Sensitivität des BRBV erklären könnten. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Wie bei anderen zeckenübertragenen Erregern empfehlen sich die Vermeidung von Zeckenbissen sowie die korrekte Entfernung festgebissener Zecken als Präventionsmaßnahmen. |
|
Wo liegen zukünftige Herausforderungen? |
|
Da BRBV auch in der invasiven Zeckenart H. longicornis nachgewiesen wurde (Cumbie et al., 2022), vergrößert sich das potenzielle Verbreitungsgebiet von Bourbon-Virus. Durch Monitoringstudien in Zecken, Wildtieren und Menschen könnte die Verbreitung von Bourbon-Virus besser eingeschätzt werden. Eine serologische Studie aus St. Louis, Missouri (Bamunuarachchi et al., 2022), bestätigt, dass Infektionen mit Bourbon-Virus auch beim Menschen relativ verbreitet sind. Die Seroprävalenz lag hier bei 0.7 % (n=440). Das legt nahe, dass viele Bourbon-Virus-Infektionen bei Menschen zu keinen oder nur schwachen Symptomen führen oder aufgrund unspezifischer Symptome falsch diagnostiziert werden. In diesem Zusammenhang sollte das Bewusstsein bei den lokalen Ärzten, Krankenhäusern und Behörden für Bourbon-Virus und andere zeckenübertragene zoonotische Viren gesteigert werden. |
| Sonstiges |
|
US-CDC Informationen zum Bourbon Virus (englisch) US_CDC Informationen zu Zeckenübertragenen Krankheiten (englisch) ZKBS Stellungnahme zu BRBV und anderen neuartigen Thogotoviren
|
Für die fachliche Unterstützung bei der Erstellung des Bourbon-Virus-Steckbriefes danken wir Elias Bendl vom Institut für Virologie, Universitätsklinikum Freiburg, Freiburg i.Br..
August 2022 - Oesophagostomum spp.
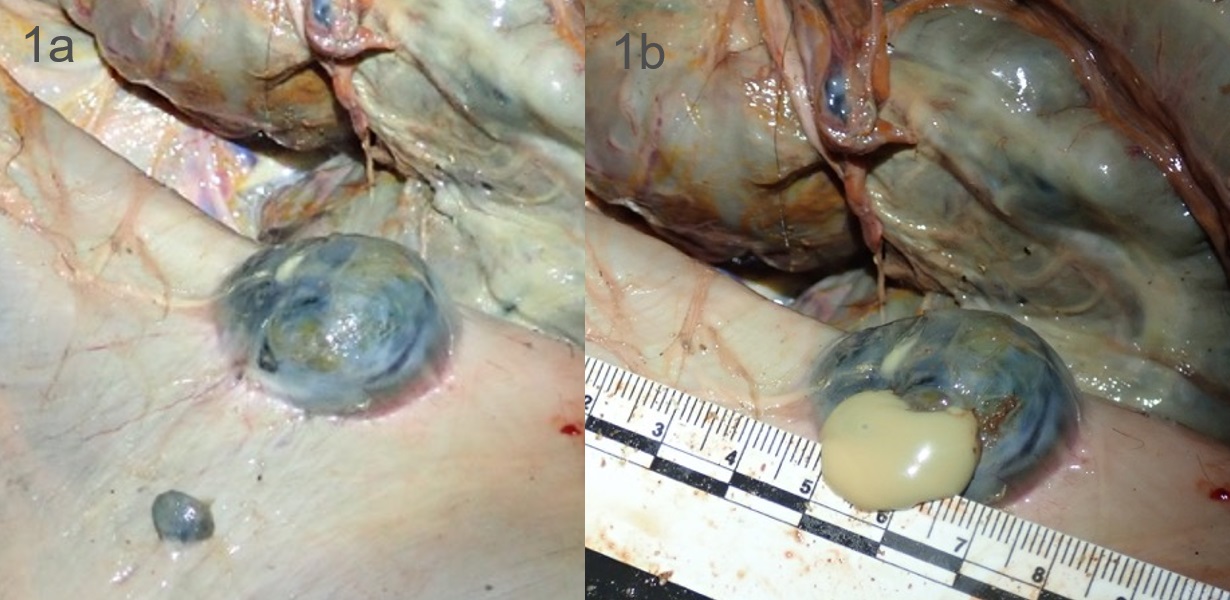
Abb.: 1a) Zwei schwarzwandige Abszesse in der Bauchdecke eines weiblichen erwachsenen Schimpansen. 1b) Größerer Knoten nach Inzision mit flüssigem beigem Eiter. Copyright: Jenny E. Jaffe/Tai Chimpanzee Project
|
Beschreibung |
|
Oesophagostomum spp. ist ein parasitischer Nematode (Fadenwurm) aus der Ordnung der Strongyloidae. Oesophagostomum bifurcum ist die am häufigsten auftretende Spezies in Afrika, die Menschen infiziert. Durch O. bifurcum verursachte knotige Läsionen im Bauchraum sind in abgegrenzten Gebieten im Norden Togos und Ghanas verbreitet. Ähnliche Läsionen (Granulome), die Larven enthalten, wurden im Bauch von infizierten Schweinen, Wiederkäuern und Primaten (Schimpansen, Gorillas und Pavianen) postmortal gefunden. O. stephanostomum, O. aculeatum und O. bifurcum wurden bei Menschen und nichtmenschlichen Primaten nachgewiesen. |
|
Erstmals entdeckt |
|
Vertreter des Genus wurden erstmals bei Menschen 1905 von Émile Brumpt im südlichen Äthiopien gefunden. Die Parasiten wurden zu Ehren ihres Entdeckers Oesophagostomum brumpti genannt. |
|
Wo kommt der Erreger vor? |
|
Oesophagostomum spp. sind weit verbreitet in Gebieten, in denen Nutztiere gehalten werden, vor allem jedoch in den Tropen und Subtropen. Die höchste Inzidenz bei Menschen ist in den nördlichen Regionen Togos und Ghanas zu verzeichnen, wo O. bifurcum (vormals als Affenparasit angesehen) in der menschlichen Population natürlich zu zirkulieren scheint. Einzelne Fälle in Menschen wurden auch in Brasilien, Malaysia, Indonesien, Französisch-Guyana und anderen Teilen West-Afrikas gemeldet. In Tieren wurden zahlreiche Oesophagostomum spp. Infektionen überall in Sub-Sahara Afrika gefunden und nur vereinzelt in Asien (Indonesien, Malaysia, China) und Brasilien. |
|
Betroffene Tierspezies, Reservoir |
|
Betroffene Spezies sind Menschen, nichtmenschliche Primaten (Affen und Gorillas), Wiederkäuer (Schafe, Kühe, Ziegen) und Schweine. Es wird vermutet, dass vorrangig nichtmenschliche Primaten das Reservoir der Parasiten bilden. In den endemischen Regionen im Norden Ghanas und Togos kommen jedoch oft auch Mensch-zu-Mensch Übertragungen vor, insbesondere kurz nach der Regenzeit. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Menschen können sich durch die orale Aufnahme infektiöser Larven (L3) infizieren. Bei kleinen Kindern und Frauen scheint es eine höhere Prävalenz für den Erreger zu geben, wenn man das Vorkommen von Parasiteneiern im Stuhl als Indikator nimmt. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
In den meisten Fällen ist der parasitäre Befall asymptomatisch, allerdings können sich knotige Läsionen (durch migrierende Larven verursachte Granulomen) im Abdomen (Dünn- und Dickdarm, sowie in der Bauchwand) bilden. Diese können einknotig („Dapaong Tumor“) oder mehrknotig (bis hin zu 100 kleineren Knoten) sein. Ein akutes Abdomen ist die häufigste Manifestation bei Menschen. Niedriges Fieber und Empfindlichkeit im unteren rechten Quadranten sind die häufigsten Symptome. Seltener treten auch Erbrechen, Appetitlosigkeit, Durchfall und Gewichtsverlust auf. Darmverschlüsse können ebenfalls auftreten. Teils werden auch Patienten mit großen, schmerzlosen Hautmassen in der unteren Bauchregion vorstellig. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Eine unkomplizierte Ösophagostomiasis kann bei einem erwachsenen Menschen mit der einmaligen Gabe von 400 – 800 mg Albendazol behandelt werden. Bei komplizierten Fällen kann eine Operation und eine Exzision (oder Schnitt und Drainage durch die Haut) notwendig sein. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Aktuell gibt es keine Überwachungssysteme für den Erreger. Die Eier der Parasiten können im Stuhl detektiert und über eine PCR oder ein einer Koprokultur mit anschließender mikroskopischer Larvenbestimmung identifiziert werden. Große Knoten können über Ultraschall gefunden werden. Das Finden intakter Würmer während einer Biopsie oder einer Autopsie erlaubt eine klare Diagnose. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Die Beobachtung, dass O. bifurcum nur in einer sehr begrenzten geographischen Region klinische Symptome beim Menschen verursacht, obwohl die Parasitenspezies in einem sehr viel größeren Areal in nichtmenschlichen Primaten vorkommt, ist sehr interessant. Es stellt sich die Frage, ob dies lediglich darauf zurückzuführen ist, dass in dieser Region ein genetisch veränderter Stamm zirkuliert, der sowohl eine Mensch-zu-Mensch Übertragung als auch die schwereren pathologischen Veränderungen ermöglicht, oder ob eventuell auch Umweltfaktoren eine Rolle spielen. Zudem gibt es noch viele unbeantwortete Fragen bei nichtmenschlichen Primaten. Es konnte bestätigt werden, dass O. stephanostomum in einigen Fällen Knoten bei Schimpansen verursachen können. Allerdings ist unbekannt, ob auch O. bifurcum, der bereits im Stuhl von Schimpansen nachgewiesen werden konnte, Knoten bei Schimpansen verursachen kann. Es ist noch ungeklärt inwieweit beide Spezies klinisch relevante Symptome in nichtmenschlichen Primaten verursachen können und welche Faktoren die Pathogenese beeinflussen. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Wiederholte Massenbehandlungen mit Albendazol (400 mg) in den endemischen Gebieten sind eine effektive Maßnahme um die Prävalenz in der menschlichen Population signifikant zu reduzieren. Schlechte Sanitärbedingungen und unhygienische Zustände, wie sie in den endemischen Regionen häufig zu finden sind, sind möglicherweise ein wichtiger Risikofaktor für das Auftreten neuer Infektionen und könnten ein guter Ansatzpunkt für Bekämpfungsstrategien sein. |
|
Wo liegen zukünftige Herausforderungen? |
|
Die Bekämpfung der durch den Boden übertragenen Helminthiasis durch eine bevölkerungsbezogene Massenbehandlung wird tendenziell durch eine schnelle Reinfektion gefährdet, da bei unbehandelten Personen und Einwanderern Infektionsreservoirs bestehen bleiben. Zudem können Eier oder Larven lange in der Umwelt überleben. Was den Kampf gegen die Parasiten zusätzlich erschwert sind die geringen Heilungsraten durch die verwendeten Medikamente und die geringe Compliance der Patienten während der Behandlung. |
| Sonstiges |
|
https://www.cdc.gov/dpdx/oesophagostomiasis/index.html GASSER, R., GRUIJTER, J., & POLDERMAN, A. (2006). Insights into the epidemiology and genetic make-up of Oesophagostomum bifurcum from human and non-human primates using molecular tools. Parasitology, 132(4), 453-460. https://doi.org/10.1017/S0031182005009406 |
Für die fachliche Unterstützung bei der Erstellung des Oesophagostomum-Steckbriefes danken wir Jenny Jaffe aus der Gruppe Epidemiologie Hochpathogener Erreger, Robert Koch-Institut, Berlin.
Juli 2022 - West-Nil-Virus
Abb.: Die Transmission des West-Nil-Virus erfolgt zwischen Stechmücken und Vögeln, aber auch Menschen und Pferde können sich mit dem Virus infizieren (Copyright: Dana A. Thal)
|
Beschreibung |
|
Das West-Nil-Virus (WNV), durch Stechmücken übertragbar, gehört zu der Familie der Flaviviridae, speziell zum Genus Flavivirus und gliedert sich aufgrund der ausgeprägten Kreuzreaktivität in den Japan-Enzephalitis-Virus-Serokomplex. Das Genom des RNA-Arbovirus ist einzelsträngig und von positiver Polarität. Membranbestandteile des behüllten Virions, welches 40-60 nm im Durchmesser groß ist, sind das virale Glykoprotein E sowie das Glykoprotein prM, welche insbesondere die Zielantigene für virusneutralisierende Antikörper verkörpern. Phylogenetisch lässt sich das WNV in derzeit bis zu neun Linien klassifizieren, von denen WNV-Linie 1 und 2 vorrangig für Ausbrüche in Wirbeltieren in Europa verantwortlich sind. |
|
Erstmals entdeckt |
|
Das WNV wurde erstmals im Jahr 1937 aus dem Blut einer fiebernden Patientin aus der West-Nil-Provinz Ugandas isoliert. Die Frau wurde aufgrund eines Gelbfieber-Verdachts untersucht, wobei dieses neue Virus entdeckt wurde. In den folgenden Jahren erhielt das WNV wenig Aufmerksamkeit, obwohl es schon Ende der 1950er Jahre Europa erreichte. Als jedoch im Jahr 1999 die ersten schweren humanen Erkrankungsfälle aus den USA gemeldet wurden, verbunden mit massenhaftem Versterben der regionalen Vogelpopulation, gelang WNV erstmals in den Fokus der Öffentlichkeit. Ende der 1990er Jahre breitete sich das Virus wieder verstärkt in Europa aus und auch hier nahm das Bewusstsein und das Interesse für das Virus nun deutlich zu. |
|
Wo kommt der Erreger vor? |
|
Das WNV kommt mittlerweile auf allen Kontinenten vor, außer in der Antarktis. Es stellt damit das geografisch am weitesten verbreitete von Mücken übertragbare Virus dar. Dabei ist es sowohl in tropischen, als auch in gemäßigten Gebieten der Erde verbreitet. |
|
Betroffene Tierspezies, Reservoir |
|
In den gemäßigten Breiten Europas zirkuliert das Virus in einem enzootischen Zyklus zwischen verschiedenen Wildvögeln und unterschiedlichen Steckmückenarten. Zu den Reservoir- beziehungsweise Amplifikationswirten, zählen unter anderem Sperlingsvögel (v. a. Rabenvögel) sowie Greif- und Eulenvogelarten. Die Übertragung im enzootischen Zyklus findet hauptsächlich durch ornithophile Stechmückenarten der Gattung Culex statt. Mückenarten, die sich nicht wirtsspezifisch ernähren, sondern Blut von verschiedenen Spezies saugen, also sowohl an Vögeln als auch an Säugern ihre Blutmahlzeit nehmen, nennt man Generalisten. Wenn durch diese sog. Generalisten das Virus aus dem Vogelkreislauf in Säugetierspezies gelangt, bezeichnet man den Überträger als Brückenvektor. WNV kann durch solche Brückenvektoren zahlreiche Säugetier- aber auch Reptilien- und Amphibienarten infizieren, welche jedoch nur Fehlwirte bzw. Endwirte einer Infektion darstellen. Lediglich der Mensch und das Pferd können bei einer Infektion auch Krankheitssymptome aufzeigen. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Der Mensch wird infiziert, wenn er von einer mit WNV-infizierten Mücke (vor allem durch Vertreter der Gattung Culex) gestochen wird. Die Übertragung von Mensch zu Mensch kann aber auch durch Bluttransfusionen, Organtransplantationen oder in seltenen Fällen durch Stillen oder im Mutterleib erfolgen. Weiterhin sind seltene humane Infektionen über Laborunfälle wie Stiche mit infizierten Nadeln, Skalpellen etc. beschrieben. Ein Risiko für autochthone WNV-Infektionen besteht vor allem für ältere, vorerkrankte und immunsupprimierte Menschen, vorrangig im Spätsommer. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Die WNV-Infektion verläuft je nach betroffener Spezies unterschiedlich: Hoch empfängliche Vogelordnungen wie Sperlings-, Greif-, und Eulenvögel können schwere (neurologische) Krankheitssymptome bis hin zu tödlichen Enzephalitiden entwickeln. Andere weniger empfängliche Vogelordnungen, wie z.B. Hühner- und Entenvögel, zeigen oft keinerlei klinische Symptome. Bei Säugetieren verläuft die WNV-Infektion asymptomatisch. Lediglich bei Pferden und Menschen kann es in seltenen Fällen zum sogenannten WNV-Fieber kommen. Dabei zeigen sich nach einer Inkubationszeit von 2-14 Tagen Fieber (teilweise biphasisch), Schüttelfrost, Kopf- und Rückenschmerzen, Abgeschlagenheit und Lymphknotenschwellungen. In Einzelfällen kann es sogar zu neurologischen Symptomen und zum Tod kommen. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt derzeit keine spezifische Therapiemöglichkeiten. Eine Infektion kann daher nur symptomatisch und bei Bedarf intensivmedizinisch therapiert werden, was jedoch nicht sicher vor einem neuroinvasiven Verlauf schützt. In Europa sind drei Impfstoffe gegen WNV für Pferde zugelassen. Die Impfstoffe schützen nicht vor einer Infektion, aber vor einem schweren klinischen Verlauf und sie verkürzen die Dauer der Virämie und verringern die Viruslast deutlich. Neben einem klassischen Totimpfstoff gibt es einen rekombinanten Lebendimpfstoff auf Kanarienpockenbasis und eine inaktivierte Chimäre auf der Basis eines Gelfieber-Impfstammes, die prophylaktisch genutzt werden können. Die Empfehlung der Ständigen Impfkommission Veterinärmedizin (StIKo Vet) lautet derzeit, Pferde, die im bekannten WNV-Endemiegebiet gehalten werden oder die während der Mückensaison z.B. im Rahmen von Pferdesportveranstaltungen in diese Gebiete verbracht werden, gegen WNV zu impfen. Hierfür sollte die zweimalige Grundimmunisierung vor Beginn der Mückensaison, d.h. vor Ende Mai, abgeschlossen sein. Weltweit ist derzeit kein WNV-Impfstoff für Menschen oder Vögel zugelassen, aber humane Impfstoffe befinden sich derzeit in klinischen Phase II Studien. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Seit vielen Jahren werden verendete Vögel deutschlandweit auch auf das Vorhandensein einer WNV-Infektion hin untersucht. Bei Pferden erfolgt dies derzeit noch nicht regelmäßig. Hintergrund ist dabei, dass eine WNV-Infektion bei Vögeln und Pferden eine anzeigepflichtige Tierseuche in Deutschland ist. Anzeigepflichtig sind ein direkter Erregernachweis aus Blut oder Organproben bei Vogel und Pferd sowie ein indirekter IgM-Nachweis aus Serum oder Plasma mittels ELISA beim Pferd. Für die humane WNV-Infektion besteht nach §7, Abs. 1 des Infektionsschutzgesetzes eine Meldepflicht für den direkten oder indirekten Erregernachweis. Das Nationale Referenzlabor (NRL) am Friedrich-Loeffler-Institut (FLI) koordiniert seit vielen Jahren ein ausgedehntes Vogelüberwachungsnetzwerk mit deutschlandweiten Kooperationspartnern aus der Avifauna, wie privaten und universitären Vogelkliniken, Ornithologen, ornithologischen Forschungsstationen, dem Bernhard-Nocht-Institut für Tropenmedizin (BNITM) in Hamburg, dem Naturschutzbund (NABU), den amtlichen Veterinäruntersuchungsämtern der Länder und seit kurzem auch mit vielen zoologischen Einrichtungen. Dieses Netzwerk trägt dazu bei, ein möglichst flächendeckendes Monitoring jährlich zu ermöglichen, indem verstorbene oder klinisch auffällige Wildvögel untersucht werden. Zudem tragen die routinemäßigen Blutuntersuchungen bei Zoovögeln zur Status-quo-Ermittlung in der Region bei. So konnte dieses Netzwerk den Eintritt von WNV in Deutschland und die Etablierung dieses neuen Erregers genau aufzeigen und ist als ein wichtiges Frühwarnsystem für die Humanmedizin anzusehen. Zusätzlich wird seit vielen Jahren deutschlandweit das Vorkommen der unterschiedlichsten Stechmückenarten überwacht und jährlich kartiert. Die Ergebnisse werden im Mückenatlas einer breiten Öffentlichkeit zur Verfügung gestellt (https://mueckanatlas.com). Weiterhin werden in verschiedenen Forschungsprojekten ausgewählte Stechmückenspezies auf potentielle Pathogene untersucht. In diesem Kontext werden auch erste Ansätze von verbesserten Mückenfallensystemen erprobt, die über die Sammlung von Mückenspeichel auf sog. FTA-Karten noch schneller wichtige Pathogene in einzelnen Regionen identifizieren können. Außerdem werden auf Anordnung des Paul-Ehrlich-Instituts (PEI) alle nicht inaktivierten Blutprodukte nach einer Blutspende aus WNV-Endemiegebieten zwischen dem 1. Juni und 30. November mittels WNV-NAT (Nukleinsäure-Amplifikationstechnik) untersucht oder für vier Wochen von der Spende zurückgestellt. Jedoch gelten Blut- und Plasmaprodukte als sicher und können WNV nicht übertragen, wenn sie mit validierten Verfahren zur Virusinaktivierung behandelt wurden. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Da zwischen den Flaviviren enge Antigengemeinschaften bestehen, kann das gleichzeitige Vorkommen mehrerer Flaviviren serologische Kreuzreaktionen hervorrufen. Von großem Interesse ist die Fragestellung, ob eine vorausgegangene Flavivirus-Infektion mit einem anderen Erreger, eine koprotektive Wirkung auf eine nachfolgende WNV-Infektion hat und den Verlauf einer Infektion abmildert. Denkbar wären solche schützenden Wirkungen einer vorangegangenen Flavivirus-Infektion bei dem seit vielen Jahren in Europa, inklusive Deutschland, zirkulierendem Usutu-Virus (USUV) oder bei dem in Spanien zirkulierendem Bagaza-Virus (BAGV). Verschiedene Forschungsgruppen gehen diesen Fragestellungen derzeit nach. Ein weiterer Forschungsschwerpunkt ist die Prophylaxe einer WNV-Infektion bei Zoovögeln, um damit wertvolle Zucht- und Zoovögel zu schützen. Erste Feldstudien haben dazu begonnen, um diese hochempfängliche Vogelspezies mithilfe eines kommerziell erhältlichen Pferdevakzines sicher vor einer Infektion in WNV-Endemiegebieten zu schützen. Des Weiteren verfolgen viele Forschungsgruppen das Ziel, verbesserte ELISAs oder andere serologische Tools zu entwickeln und zur Marktreife zu bringen, die sicher zwischen verschiedenen nah verwandten Flaviviren, wie beispielsweise Dengue-Virus und seinen Serotypen, Zika-Virus, USUV oder Frühsommer-Meningoenzephalitis-Virus (FSMEV), bei Mensch und Tier differenzieren können. |
|
Welche Bekämpfungsstrategien gibt es? |
|
In Deutschland gibt es derzeit keine Bekämpfungsstrategie, weder in der Humanmedizin, noch in der Veterinärmedizin. Eine wichtige Prophylaxe für den Menschen zur Vermeidung von Mückenstichen ist das Tragen langer Kleidung sowie das Verwenden von Repellentien und Moskitonetzen/-gittern in WNV-endmischen Regionen. Um eben diese WNV-Endemiegebiete zu kennen, ist ein akribisches Überwachungsnetzwerk sowie eine gute Aufklärung/Beteiligung der Öffentlichkeit essentiell. Des Weiteren sollten stehende Gewässer (z. B. in Regentonnen) vermieden werden, um die Hausmücke als Hauptüberträger zu dezimieren. Die Anwendung solcher Präventivmaßnahmen sollte die erste Bekämpfungsmaßnahme sein, bevor der lokale/regionale Einsatz von Bioziden (v.a. Adultiziden) angedacht wird. Es wird empfohlen Pferde, die im bekannten WNV-Endemiegebiet gehalten werden oder die während der Mückensaison z.B. im Rahmen von Pferdesportveranstaltungen in diese Gebiete verbracht werden, gegen WNV zu impfen (StIKo Vet). |
|
Wo liegen zukünftige Herausforderungen? |
|
Der Klimawandel hat die Etablierung von WNV in Deutschland begünstigt: Längere und wärmere Sommer erleichtern die Ausbreitung von Stechmücken und deren Pathogenen, da sich auch die Zeit der Virusvermehrung nach einer Blutmahlzeit in den Stechmücken bei höheren Umgebungstemperaturen deutlich verringert, wodurch das Virus schneller an den nächsten Wirbeltierwirt weitergegeben werden kann. Gleichzeitig halten sich Menschen bei warmen Temperaturen vermehrt im Freien auf und erhöhen dadurch ihr Risiko, gestochen zu werden und sich mit dem Virus zu infizieren. Auch warme Winter bieten den Mücken gute Bedingungen für die Überwinterung, was bereits für Stechmücken in einem Überwinterungshabitat in Deutschland gezeigt werden konnte. Daher ist zukünftig eine regionale Verbreitung in Deutschland und möglicherweise darüber hinaus nord- und westwärts in Europa sehr wahrscheinlich. Der erste WNV-Nachweis in einem Vogel und in Stechmücken in den Niederlanden erfolgte im September 2020, gefolgt von der ersten bestätigten humanen WNV-Infektion einem Monat später in dieser Region. |
| Sonstiges |
|
Nationales Referenzlabor für West-Nil-Virus (WNV) am FLI Interview zur WNV Ausbreitung in Deutschland (Teil 1, Teil 2, Teil 3) |
Für die fachliche Unterstützung bei der Erstellung des West-Nil-Virus-Steckbriefes danken wir Dr. Cora M. Holicki, Hannah Reemtsma, Felicitas Bergmann und Dr. Ute Ziegler vom Institut für neue und neuartige Tierseuchenerreger am Friedrich-Loeffler-Institut.
Juni 2022 - Bartonella spp.
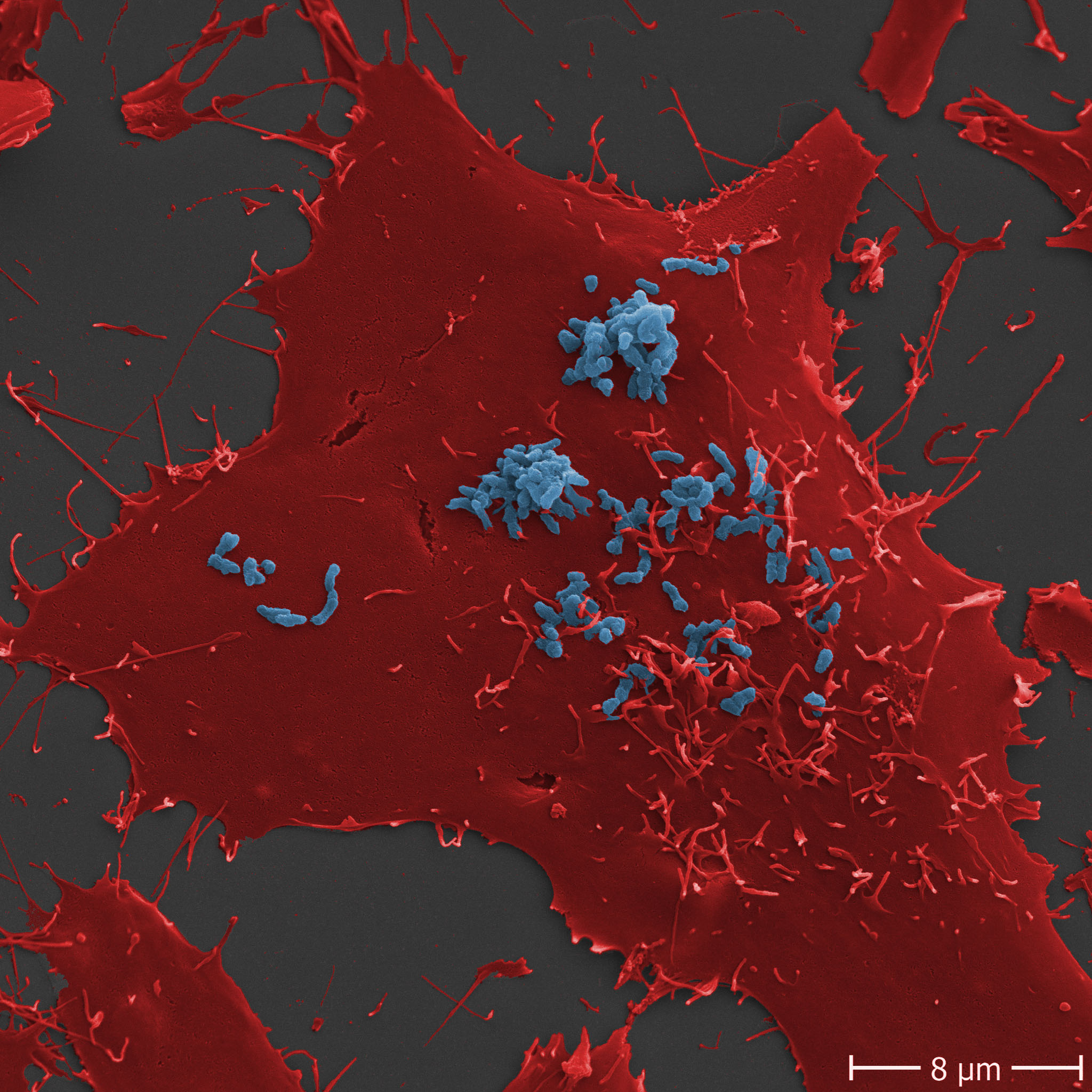
Abb.: Übertragung von Bartonella henselae (Stamm Marseille) auf menschliche Zellen: B. henselae (hellblau) in einem frühen Stadium der Infektion (30 Minuten) mit menschlichen HeLa-229-Zellen (rot). Maßstabsbalken: 8 μm, Copyright: Veröffentlicht mit der Genehmigung von Prof. V. Kempf, Konsiliarlabor für Bartonella, Universitätsklinikum Frankfurt am Main (aus: van Belkum et al. 2021, https://www.mdpi.com/2075-4418/11/7/1259).
|
Beschreibung |
|
Die Gattung Bartonella (Familie: Bartonellaceae; Ordnung: Rhizobiales) umfasst eine Gruppe von fakultativ intrazellulären Alpha-Proteobakterien mit bisher 84 beschriebenen Spezies bzw. Subspezies. Die wichtigsten zoonotischen Vertreter sind Bartonella bacilliformis, Bartonella henselae und Bartonella quintana auf, die in dem folgenden Steckbrief näher eingegangen werden soll. |
|
Erstmals entdeckt |
|
Die erstmalige Beschreibung von ‚Bartonella‘ erfolgte im Jahr 1905. In Peru gab es einen Ausbruch unter ausländischen Arbeitern, die nach La Oroya reisten, um am Bau der Eisenbahnlinie Oroya-Lima tätig zu sein. Die meisten der Arbeiter wurden in das Krankenhaus von Guadalupe gebracht und starben an einer unbekannten Krankheit, die durch Fieber und schwere Anämie gekennzeichnet war. Daraufhin stellte der Wissenschaftler Alberto Barton Forschungen zur Ursache des Ausbruchs an. Am 5. Oktober 1905 gab er auf einer wissenschaftlichen Tagung die Entdeckung der dafür verantwortlichen Bakterien erstmals bekannt. Das erste Manuskript wurde 1909 in der Zeitschrift Crónica Médica veröffentlicht. Im Jahr 1913 traf Richard P. Strong von der Harvard University in Peru ein, um weitere Untersuchungen bezüglich der genannten Tropenkrankheiten in Südamerika voran zu treiben. Strong bestätigte Bartons Entdeckung und benannte das Bakterium ‚Bartonia‘ zu Ehren von Barton; die Bakterienart wurde später Bartonella bacilliformis genannt. |
|
Wo kommt der Erreger vor? |
|
Es ist davon auszugehen, dass Bartonellen zumindest in Reservoirwirten wie z.B. Kleinsäugern ubiquitär vorkommen. Das Vorhandensein von Bartonella bacilliformis ist auf den südamerikanischen Kontinent beschränkt. Die dadurch verursachte Erkrankung kommt vor allem an den westlichen Hängen der Anden vor, wobei Peru, Ecuador und Kolumbien die an häufigsten betroffenen Ländern darstellen. Die Erkrankung kommt vor allem fokal in 600 – 3.200 m hoch gelegenen Gebirgstälern vor. Fälle in anderen Teilen der Welt treten bei Reisenden auf, die sich vermutlich bei einem Besuch in einem dieser Länder infiziert haben. Die Katzen-Kratz-Krankheit (engl.: Cat-Scratch-Disease; CSD) ist eine ubiquitäre Zoonose, die durch Bartonella henselae, seltener auch von anderen Bartonellen-Arten verursacht wird. Fälle von CSD treten weltweit auf, wobei die Inzidenz in Regionen mit höheren Temperaturen und höherer Luftfeuchtigkeit, die eine stabile Flohpopulation begünstigen, größer ist. Erreger des Wolhynischen Fiebers oder Grabenfiebers (Trench fever) ist Bartonella quintana. Die Krankheit kam in den beiden letzten Weltkriegen in Europa und in Mexiko vor. Endemische Foki sollen noch in Russland, Mexiko, Bolivien, Nordafrika, Burundi und Äthiopien bestehen. |
|
Betroffene Tierspezies, Reservoir |
|
Für B. bacilliformis und B. quintana ist bisher kein Wildtier-Reservoir bekannt. Katzen sind weltweit das Hauptreservoir für B. henselae. Katzen entwickeln selten klinische Symptome, aber es kann zu einer langfristigen rezidivierenden Bakteriämie kommen. Junge, <1 Jahr alte, und von Flöhen befallene Katzen weisen häufiger eine Bakteriämie auf als ältere und nicht Floh-befallene Katzen. Es wurde festgestellt, dass eine Infektion mit B. henselae bei Katzen nicht transplazentar übertragen wird, allerdings schützen mütterliche Antikörper die Jungen nur in den ersten sechs Lebenswochen. Schwere klinische Manifestationen und Todesfälle im Zusammenhang mit Bartonella-Infektionen werden bei Katzen sehr selten berichtet. Studien haben jedoch gezeigt, dass B. henselae Fieber, Anämie, Lethargie, leichte neurologische Symptome, und Fortpflanzungsstörungen bei Katzen verursachen kann, die entweder natürlich oder experimentell infiziert wurden. Bei Hunden wurden Infektionen mit B. clarridgeiae, B. elizabethae, B. henselae, B. koehlerae, B. rochalimae, B. quintana, B. vinsonii subsp. berkhoffii festgestellt. Die klinischen Anzeichen und Symptome einer Bartonellose bei Hunden ähneln denen beim Menschen: Endokarditis, lymphozytäre Hepatitis, Anämie, Gewichtsverlust, granulomatöse Hepatitis, Epistaxis, Myokarditis, Uveitis und Splenomegalie. Generell gibt es wenige Fallberichte bei Hunden, jedoch immer noch häufiger als bei Katzen. Hunde dienen als Reservoirwirte sowohl für B. rochalimae als auch für B. vinsonii subsp. berkhoffii. Bartonella bovis kann nachweislich eine infektiöse Endokarditis bei Rindern verursachen. Es konnten auch Bartonellen in asymptomatischen Schafen nachgewiesen werden. Die Auswirkungen von Bartonella auf Ziegen, Pferde oder Schweine ist weitestgehend unbekannt. Wildlebende Kleinsäuger sind weltweit die größte Reservoir-Gruppe was die Speziesdiversität von Bartonellen aber auch die Bartonella-Prävalenz in Kleinsäugern selbst angeht. Insgesamt wurden Bartonellen in mehr als 200 Kleinsäugerspezies weltweit nachgewiesen. Hierbei wurden Studien vermehrt an Individuen der Gattung Rattus durchgeführt. Bis heute ist die Pathogenität vieler in Kleinsäugern vorkommenden Bartonellen-Arten nicht hinreichend geklärt. Es gibt jedoch nachweislich mehrere Arten wie z.B. Bartonella tribocorum (Hauptreservoir: Wanderratte) oder B. grahamii (Hauptreservoir: Wühlmäuse) die Symptome beim Menschen auslösen können. Es ist davon auszugehen, dass die Kleinsäuger jedoch selbst keine Symptomatik zeigen. Unterschiedliche Bartonellen-Arten können ebenfalls in einer Vielzahl anderer wildlebender Säugetiere nachgewiesen werden wie z.B. in Dromedaren, Rehen, Waschbären oder Rotluchsen. Für die meisten dieser Bartonellen-Spezies ist noch nicht hinreichend geklärt, ob sie zoonotisches Potential haben. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Generell werden Bartonellen durch Blut-saugende Arthropoden wie Flöhe, Läuse, oder auch Hirschlausfliegen übertragen. Bartonella bacilliformis wird durch den Stich von Phlebotomen der Gattung Lutzomyia übertragen. Reservoir sind teilimmune, infizierte Menschen; ein Tierreservoir ist nicht bekannt. Die Übertragung von B. henselae wird mit Kratzverletzungen sowohl von Katzen als auch von Hunden in Verbindung gebracht. Zwischen den Katzen wird die Infektion vor allem durch Katzenflöhe (Ctenocephalides felis) übertragen. Bartonella quintana wird durch infizierten Kleiderlaus-Kot (Pediculus humanus corporis), der in bestehende Wunden eingerieben wird, auf Menschen übertragen. Eine Tierreservoir ist nicht bekannt. Tierärzt*innen, Tierarzthelfer*innen und Tierpfleger*innen scheinen ein erhöhtes Infektionsrisiko zu haben und sind in besonderem Maße Reservoirwirten und Vektoren von Bartonella spp. ausgesetzt. Katzen- und Hundebesitzer scheinen ebenfalls einem erhöhten Infektionsrisiko ausgesetzt zu sein. Es wurde festgestellt, dass Besitzer einer Katze, die jünger als 12 Monate ist, ein erhöhtes Risiko für eine Infektion mit B. henselae haben im Vergleich zu Katzenbesitzern mit einer Katze, die älter ist. Kinder und Jugendliche sind hierbei am häufigsten betroffen. Waldarbeiter scheinen eine weitere Risikogruppe zu sein. Ein höheres Infektionsrisiko wird auch für Obdachlose, Alkohol- und Drogenabhängige beschrieben, die sich Substanzen intravenös verabreichen. Dies scheint jedoch weniger an einem intravenösen Übertragungsweg zu liegen, als an der mangelnden Hygiene und somit einer höheren Wahrscheinlichkeit von einem Ektoparasitenbefall betroffen zu sein. Krankheitsverläufe von B. henselae-Infektionen sind in der Regel selbstlimitierend und mild. Es wird beschrieben, dass Patienten, die der YOPI (engl. Abkürzung für young, old, pregnant, immunosuppressed) Gruppe angehören, aufgrund ihres geschwächten Immunsystems schwerere Krankheitsverläufe haben können. In letzter Zeit war das Wolhynische Fieber häufiger bei HIV-positiven Menschen und bei Obdachlosen in Großstädten zu beobachten. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
Bei den meisten Betroffenen ist die Carrion-Krankheit durch zwei klar definierte Stadien gekennzeichnet: (1) eine plötzliche, akute Phase, die als Oroya-Fieber bekannt ist, und (2) ein chronischer, gutartiger Hautausschlag, der aus erhabenen, rötlich-violetten Knötchen besteht, die als verruga peruana (peruanische Warze) bekannt sind. Die Läsionen können anfangs winzig sein, später knötchenförmig werden und einen Durchmesser von 0,2 bis 4 Zentimetern haben. Sie können bluten, eitern oder zu eiterhaltigen Blasen (Pusteln) werden. Bei unbehandelten Personen kann die verruga peruana über einen Zeitraum von Monaten bis zu mehreren Jahren bestehen bleiben. Das erste Stadium entwickelt sich in der Regel etwa drei bis 12 Wochen nach der Infektion mit B. bacilliformis. Das Oroya-Fieber kann durch plötzlich einsetzendes hohes Fieber, starkes Schwitzen, starke Kopfschmerzen, Schüttelfrost, Schwäche und Blässe der Haut gekennzeichnet sein. Weitere Begleitbefunde können Bauchschmerzen, starke Muskelschmerzen und Arthralgie sein. Darüber hinaus können einige Betroffene Brustschmerzen aufgrund einer unzureichenden Sauerstoffversorgung des Herzmuskels (Angina pectoris) entwickeln. Weitere Begleiterscheinungen sind Thrombozytopenie, und eine beeinträchtigte Verdauungs- und Leberfunktion. Man geht davon aus, dass diese Befunde auf eine schwere hämolytische Anämie und die abnorme Bildung von Blutgerinnseln in kleinen Blutgefäßen (mikrovaskuläre Thrombose) zurückzuführen sind, die zu einer unzureichenden Sauerstoffversorgung des Gewebes (Ischämie), einer Beeinträchtigung der Organfunktion und potenziell lebensbedrohlichen Komplikationen führen können. Bei einigen Patienten kommt es zu einer Neurobartonellose, die sich als Meningoenzephalitis mit Meningismus, Bewusstseinsstörungen, Krampfanfällen und Lähmungen manifestiert. Weitere Komplikationen sind respiratorische Insuffizienz, Myokarditis, Perikardergüsse, Schock und Multi-Organ-Versagen. Darüber hinaus kann die akute Phase der Carrion-Krankheit bei einigen Patienten durch das Vorhandensein anderer Infektionen wie Salmonellose oder Malaria (d. h. interkurrente Infektionen) verkompliziert und in ihrer Schwere verstärkt werden. Bei Schwangeren kann es zu Aborten führen. Diaplazentare und konnatale Infektionen wurden beschrieben. Unbehandelt ist die Letalität des Oroya-Fiebers hoch (bis zu 90%).
Die Hauptsymptome der CSD treten erst nach mehreren Tagen nach der Exposition auf. An der Infektionsstelle kann ein roter Fleck (Makula) auf der Haut erscheinen, der sich 3 bis 10 Tage nach der Exposition erheben kann (Papel). Die Papel ist schmerzlos und juckt nicht. Sie kann sich mit Flüssigkeit füllen, dann verkrusten und mit einer Narbe abheilen, ähnlich wie bei Windpocken. Innerhalb von 1 bis 3 Wochen entwickelt sich in den meisten Fällen eine Lymphadenopathie (>90%) in einem einzelnen Knoten oder einer Gruppe regionaler Knoten in der Nähe der Biss- oder Kratzstelle. Geschwollene Lymphknoten treten häufig unter den Armen, am Hals oder in der Leistengegend auf. Diese sind dolent, und beweglich, gelegentlich vereitern sie (bis 15%). Die Lymphadenopathie bleibt regional und bildet sich in der Regel innerhalb von 2 bis 4 Monaten zurück. Weitere Symptome der Katzenkratzkrankheit sind meist unspezifisch und können allgemeines Unwohlsein, Anorexie, Müdigkeit, Kopfschmerzen und bei einigen Patienten mäßiges Fieber sein. Zu den weniger häufigen Symptomen gehören Appetitlosigkeit und Halsschmerzen. Meist handelt es sich um eine gutartige, selbstlimitierende Erkrankung die unbehandelt innerhalb von 6–12 Wochen spontan abheilt. Die bazilläre Peliosis, eine Form der Peliosis hepatis, ist eine durch B. henselae verursachte Gefäßerkrankung. Sie ist durch das Vorhandensein von blutgefüllten Hohlräumen in der Leber gekennzeichnet, tritt jedoch sehr selten nach einer B. henselae-Infektion auf. Das okuloglanduläre Parinaud‘sche-Syndrom, das das Auge betrifft, tritt bei etwa 5% der Patienten nach Inokulation von B. henselae in die Konjunktiva auf. Zu den Symptomen gehören ein rotes, gereiztes und schmerzhaftes Auge (ähnlich einer Bindehautentzündung), Fieber, allgemeines Unwohlsein und eine Schwellung der nahe gelegenen Lymphknoten, häufig vor dem Ohr (präaurikuläre Lymphadenopathie). Möglich ist auch eine granulomatöse Entzündung der hinteren Augenabschnitte mit Neuroretinitis und transitorischem Visusverlust bis hin zur völligen Erblindung, die sich jedoch innerhalb einiger Monate meist ohne Residuen zurückbildet. Neurologische Komplikationen treten bei etwa 2 % der infizierten Patienten auf, wobei die Enzephalopathie die häufigste Erscheinungsform ist.
Die durch die Infektion von B. quintana verursachten Symptome kommen innerhalb weniger Tage bis hin zu fünf Wochen nach der Exposition zum Vorschein. Die Betroffenen können plötzliches Fieber, Schüttelfrost, Schwäche, Kopfschmerzen, Schwindel, und Bein- und Rückenschmerzen entwickeln. Das anfängliche Fieber hält etwa vier bis fünf Tage an und kann ein- oder mehrmals wiederkehren, wobei jede Episode etwa fünf Tage dauert. Weitere Befunde können ein vorübergehender Hautausschlag sein, der aus makulösen oder papulösen Läsionen besteht, und/oder eine Vergrößerung der Leber oder Milz (Hepatomegalie oder Splenomegalie). Das Grabenfieber ist in der Regel eine selbstlimitierende Krankheit, obwohl Rückfälle und chronische bakteriämische Zustände durchaus bekannt sind. Eine schwere Form der B. quintana-Infektion wurde auch bei immungeschwächten Personen beobachtet. Infektionen mit B. quintana und anderen Bartonellen können Ursache von Kultur-negativen Endokarditiden sein. Das klinische Bild entspricht einer subakuten Endokarditis. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt keinen Impfstoff für Bartonellen. Die Behandlung der Wahl für das Oroya-Fieber ist die Verabreichung des Antibiotikums Chloramphenicol (wegen der häufigen, gleichzeitigen Infektion mit Salmonellen). Auch Ciprofloxacin wird empfohlen. Die Katzenkratzkrankheit klingt in der Regel innerhalb von 2 bis 4 Monaten ohne jegliche Behandlung ab. Die Therapie ist symptomatisch und unterstützend. Antipyretika und Analgetika können je nach Bedarf verabreicht werden. Bei schweren oder systemischen Erkrankungen können Antibiotika in Betracht gezogen werden. Antibiotika, die sich als wirksam erwiesen haben, sind Rifampin, Ciprofloxacin, Gentamicin und Trimethoprim/Sulfamethoxazol. Bartonella henselae ist im Allgemeinen resistent gegen Penicillin, Amoxicillin und Nafcillin. Unkomplizierte Erkrankungen können mit Doxycyclin alleine behandelt werden. Bei chronisch bakteriämischen Erkrankungen und bei Endokarditis ist eine Kombinationstherapie mit Doxycyclin (2x 100mg/tägl. über 6 Wochen) und Gentamicin (3mg/kg über 14 Tage) angezeigt. Die Behandlung des Wolhynischen Fiebers kann analog zu der der Katzenkratzkrankheit erfolgen. Meist wird mehr als ein Antibiotikum in Kombination verwendet. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Die endemischen Herde von B. bacilliformis sind sehr lokal begrenzt und haben sich seit der erstmaligen Entdeckung der Bakterien nicht maßgeblich ausgebreitet, was an der sehr fokal begrenzten Abundanz des hierfür notwendigen Vektors, der Sandmücke, liegt. Aus diesem Grund gibt es für dieses Pathogen kein Überwachungssystem. In Mitteleuropa ist nur die Katzenkratzkrankheit von relevanter Bedeutung. Da die Krankheit jedoch relativ selten ist und eine Infektion oft selbstlimitierend außerdem mit unspezifischen Symptomen einhergeht, gibt es in Mitteleuropa kein Überwachungssystem. Für B. quintana gibt es ebenfalls kein Überwachungssystem, da die Infektionsherde fokal sehr begrenzt sind und von der Abundanz von infizierten Vektoren abhängen. Die Abundanz von diesen Vektoren (Kleiderläuse) wiederum ist ebenfalls lokal sehr begrenzt da die Vektoren eine sehr begrenzte geografische Reichweite haben und sehr wirtsspezifisch sind. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
In den letzten 15 Jahren wurden und werden immer mehr neue Bartonellen-Arten in Arthropoden wie auch in Reservoirwirten beschrieben. Hier scheinen sich vermehrt epidemiologische Lücken zu schließen. Weitere Forschung zur Prävalenz von Bartonella spp., zum Infektionsrisiko und zur Pathobiologie bei diesen Säugetierwirten und Vektoren durch Verwendung experimenteller in-vitro und in-vivo Modelle scheint dennoch notwendig. Die Kultivierung von Bartonellen erweist sich außerdem als schwierig, da sie eine sehr lange Wachstumsphase von bis zu 4 Wochen haben, sodass die meisten der neu beschriebenen Bartonellen noch nicht hinreichend charakterisiert werden konnten und somit das zoonotische Potential nicht bekannt ist. Des Weiteren ist es so nicht immer möglich eine Art von einer Unterart zu unterscheiden. Dadurch, dass Komplettgenom-Analysen immer erschwinglicher werden, ist es jedoch sehr wahrscheinlich, dass dieses Problem zumindest in naher Zukunft gelöst wird. Trotz erheblicher Anstrengungen und großer wissenschaftlicher Fortschritte, sind die genauen Prozesse wie z.B. Bartonellen die Erythrozyten des Wirtes infizieren bis heute nicht ausreichend geklärt. Die Funktionen der bekannten Virulenzfaktoren sind noch nicht vollständig erforscht. Desweitern ist es möglich, dass manche Virulenzfaktoren bis heute noch unentdeckt sind. Darüber hinaus sind die Genexpression, die Regulierung und die zeitlichen und räumlichen Signaltransduktionswege dieser Faktoren immer noch nicht klar. Auch über die physiologischen Veränderungen und Erkennungsrezeptoren der Zielzellen (Erythrozyten) während der Infektion wissen wir wenig. Jüngste Erkenntnisse haben jedoch unser Verständnis über den bemerkenswerten evolutionären und ökologischen Erfolg der Bartonellen, erheblich erweitert. Dies führte zur Entstehung einer großen Anzahl von Arten, die jeweils so angepasst sind, dass sie in ihrem spezifischen Säugetier-Reservoirwirt eine hochprävalente Infektion verursachen können. Parallele Pfade konvergenter und divergenter Evolution werden für Bartonellen vermutet und sollten als Basis für experimentelle Evolutionsexperimente im Zusammenhang mit Wirtsadaptation dienen. Zusammenfassend lässt sich sagen, dass es noch viele spannende und wichtige Fragen im Forschungsfeld der Bartonellen zu beantworten gibt. Dieses offene Forschungsfeld erstreckt sich hierbei über epidemiologische Fragestellungen, komplexe Interaktionen in der Schnittstelle von Pathogen, Vektor und Wirt, bis hin zu Fragen auf molekularer Ebene im Bereich Pathogen-Zell-Interaktion. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Da der Infektionsweg wie auch die Reservoirwirt- und Vektorenart für die jeweiligen Bartonellen-Arten nicht einheitlich sind gibt es kein einheitliches Bekämpfungsprogramm gegen Bartonellen. In Regionen, die als Endemiegebiet für B. bacilliformis gelten, wird empfohlen geeignete Repellentien zu verwenden und langärmelige Kleidung wie auch lange Hosen zu tragen, um Sandfliegenstiche zu vermeiden. Generell sollte man sich in diesen Gebieten in der Morgen- und Abenddämmerung nicht im Freien aufhalten, da zu dieser Zeit die Sandfliegen am aktivsten sind. Um eine Infektion durch B. henselae zu vermeiden sollte der Kontakt zu insbesondere jungen und streunenden Katzen vermieden werden. Dies ist insbesondere wichtig für Menschen mit einem geschwächten Immunsystem. Nach dem Umgang mit Katzen sollte man sich sofort die Hände waschen. Weiterhin sollte man eine Ektoparasiten-Prophylaxe (gegen Flöhe) vor allem bei Katzen verwenden, die Freigänger sind. Um die Infektion mit B. quintana zu vermeiden, wird davon abgeraten Kleidung, Betten, Bettwäsche oder Handtücher mit Personen zu teilen, die möglicherweise Läuse haben. Regelmäßige Körperpflege und ausreichend häufiges Wäschewaschen können für die Vermeidung von B. quintana-Infektionen beim Menschen entscheidend sein. Wenn Kleidung oder Bettwäsche mit Läusen befallen ist, sollte diese bei mindestens 55°C gewaschen werden um Läuse und ihre Eier abzutöten. |
|
Wo liegen zukünftige Herausforderungen? |
|
Human- wie auch Veterinärmediziner sollten sich über die Ökologie und die Risikofaktoren im Zusammenhang mit den bekanntesten endemischen Arten, wie B. henselae und B. quintana, bewusst sein, aber auch über die Variabilität der klinischen Symptomatik. Bis heute wird die Bartonellose selten als ernstzunehmende Differentialdiagnose geführt und eine Infektion erst spät erkannt. Aufgrund der komplexen klinischen Erscheinungsformen könnten die Auswirkungen dieser Bakterien auf die menschliche Gesundheit bedeutender sein, als derzeit angenommen wird. Das fehlende Wissen über die geografische Verbreitung von z.B. B. quintana und die Rolle neu beschriebener Vektoren und Reservoirwirte lässt vermuten, dass Bartonellen in Zukunft in weiteren Gebieten als endemisch gelten werden - insbesondere in Gebieten mit begrenztem Zugang zu Wasserressourcen. Es scheint klar zu sein, dass der beste Weg zur Eliminierung von B. quintana oder B. henselae als Krankheitserreger für den Menschen in einer weltweiten Verbesserung der sanitären Bedingungen besteht. Doch obwohl sich diese Bedingungen seit 1918 weltweit zweifellos verbessert haben, berichten die Vereinten Nationen, dass in vielen Teilen der Welt der Zugang zu Wasser und somit sanitären Anlagen nicht ausreichend ist, und sich in den letzten Jahrzehnten nicht verbessert, in manchen Teilen der Welt sogar drastisch verschlechtert hat. Darüber hinaus sollte berücksichtigt werden, dass die Behandlung einer Bartonellose langwierig und komplex sein kann und viele betroffene Gruppen wie z.B. Obdachlose keinen Zugang zu solch einer klinischen Behandlung haben und durch den Mangel an einer sanitären Versorgung prinzipiell eher für das Erkranken an einer Bartonellose prädisponiert sind. In Deutschland wird die Zahl der Obdachlosen in keiner Bundesstatistik erfasst. Es gibt jedoch Schätzungen, dass die Zahl der Wohnungslosen hierzulande eine steigende Tendenz hat. Dies könnte auch dazu führen, dass Bartonellen sich insbesondere in dieser Bevölkerungsgruppe ausbreiten. Schließlich sind die durch den Klimawandel bedingten, immer häufiger vorkommenden Naturkatastrophen Auslöser für regionale Verwüstungen. Diese können die Sanitär- und Lebensbedingungen maßgeblich lokal beeinflussen. Weiterhin fördert der Klimawandel das Auftreten von nicht endemischen Arthropoden-Arten in Regionen mit bisher milderem Klima. Die Entwicklung und Populationsdichte des Katzenflohs (Hauptvektor von B. henselae) z.B. wird maßgeblich durch eine erhöhte Umgebungstemperatur positiv beeinflusst. Somit könnten sich auch bestimmte Bartonellen-Arten in nördlicheren Regionen der Welt weiter ausbreiten. |
| Sonstiges |
|
https://lpsn.dsmz.de/genus/bartonella https://www.cdc.gov/bartonella/index.html |
Für die fachliche Unterstützung bei der Erstellung des Bartonella-Steckbriefes danken wir Dr. Anna Obiegala vom Institut für Tierhygiene und Öffentliches Veterinärwesen an der Universität Leipzig.
Mai 2022 - Rifttalfiebervirus
Abb.:Histopathologische (A) und immunhistochemische (B) Darstellung der Leber einer akut an Rifttalfieber erkrankten Maus. In A ist eine schwere, akute, diffuse, nekrotisierende Hepatitis mit typischen Councilman Einschluss-körperchen (Pfeile) zu sehen. B zeigt eine koaleszierende bis diffuse Antigen-verteilung in den Hepatozyten. Die Linien entsprechen 50µm. Copyright: Prof. Dr. Reiner Ulrich (Gutjahr et al. 2020, PLoS Negl Trop Dis., 14(3))
|
Beschreibung |
|
Das Rifttalfiebervirus (RVFV) ist ein Virus aus der Ordnung Bunyavirales. Es ist ein behülltes Virus mit einem einzelsträngigen RNA-Genom negativer Polarität. Das Virus kann eine schwere hämorrhagische Fiebererkrankung im Menschen auslösen und zu hohen ökonomischen Verlusten in der Landwirtschaft aufgrund von sogenannten „abortion storms“ bei Wiederkäuern führen. Das Rifttalfiebervirus ist gemäß Biostoffverordnung in die Risikogruppe 3 eingestuft. |
|
Erstmals entdeckt |
|
Die Erstbeschreibung des Virus stammt aus dem Jahr 1931. Nach ungewöhnlich starken Regenfällen kam es auf einer Schaffarm in der Nähe des Naivasha-Sees im Rift Valley in Kenia zu einem großen Ausbruch eines bisher unbekannten Erregers. Die Krankheit verursachte vor allem verheerende Verluste bei neugeborenen Lämmern, aber auch eine hohe Sterblichkeitsrate bei Mutterschafen konnte beobachtet werden. Zudem kam es zu einer hohen Anzahl an Aborten, wodurch der für diese Erkrankung typische Begriff „abortion storms“ geprägt wurde. Da die schwersten Läsionen in der Leber festgestellt wurden, wurde die Krankheit zunächst als "enzootische Hepatitis" bezeichnet. Bei den Untersuchungen wurde festgestellt, dass Menschen, die dem Virus ausgesetzt waren fiebrige, aber nicht tödliche Erkrankungen entwickelten. Aufgrund der Art der Erkrankung beim Menschen und des Ortes der Erstbeschreibung wurde das Virus schnell als Rifttalfiebervirus umbenannt. |
|
Wo kommt der Erreger vor? |
|
Seit der Erstbeschreibung 1931 konnten über die Jahre große Ausbrüche in verschiedenen Ländern Afrikas registriert werden. 1977 kam es zu einem Ausbruchsgeschehen in Ägypten und somit erstmalig zu einem Ausbruch nördlich der Sahara. Im Jahr 2000 konnte das Virus zum ersten Mal den afrikanischen Kontinent verlassen und es kam zu einem Ausbruchsgeschehen auf der Arabischen Halbinsel. Inzwischen kann das Virus regelmäßig in großen Teilen Afrikas, auf dessen vorgelagerten Inseln und auf der Arabischen Halbinsel nachgewiesen und Ausbrüche registriert werden. Zudem sind in der Literatur erste Nachweise von Virusreplikation in der Türkei und im Iran beschrieben. |
|
Betroffene Tierspezies, Reservoir |
|
Die Frage des natürlichen Reservoirs konnte bis lange noch nicht vollständig geklärt werden. Eine Theorie ist, dass das Virus ein Wirbeltierreservoir hat und es beispielsweise in interepidemischen Phasen zwischen dem Vektor (Mücken) und Wildtieren wie Büffeln zirkuliert. Andere Studien zeigen, dass möglicherweise die Hausratte ein Reservoir sein könnte. Zusätzlich gibt es Hinweise auf eine transovarielle Übertragung bei der Mücke (Weitergabe über die Eizellen an die Folgegeneration), die zum Viruserhalt dienen könnte. Bei den betroffenen Tierspezies handelt es sich vor allem um Hauswiederkäuer, bei denen besonders kleine Wiederkäuer wie Schafe und Ziegen eine hohe Empfänglichkeit aufweisen. Aber auch Tiere aus der Familie der Camelidae können sich infizieren und am Virus erkranken. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
RVFV Ausbrüche treten vor allem nach hohen Niederschlägen auf. Dies liegt daran, dass es dadurch zu einem Massenschlupf an Mücken kommen kann. Mücken der Gattung Aedes gelten als Primärvektor für RVFV, wodurch erste Übertragungen entstehen. Mit Hilfe von Mücken anderer Gattungen, wie beispielsweise Culex, können nach einem Massenschlupf große Ausbrüche entstehen, bei denen sich Menschen direkt durch Mückenstiche infizieren können. Zum anderen aber infizieren sich Menschen vor allem bei dem Kontakt mit abortiertem Material, infektiösem Blut, Aerosole oder anderem infektiösem Gewebe verendeter Tiere. Daher sind besonders Landwirte, Tierärzte und Schlachthausmitarbeiter einem hohen Risiko ausgesetzt sich mit RVFV zu infizieren. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Besonders auffällig bei RVFV Ausbrüchen in Tieren sind die bereits erwähnten „abortion storms“ bei denen teilweise alle trächtigen Tiere einer Herde abortieren. Neben dem, erkranken vor allem besonders junge Tiere schwer bis tödlich daran und zeigen dabei vor allem aufgrund einer schweren Hepatitis Symptome wie hohes Fieber, Abdominalschmerzen, schwere, angestrengte Atmung und Blutungen im Gastrointestinaltrakt. Adulte Tiere hingegen zeigen meist nur leichtes Fieber mit Durchfall und Nasenausfluss. Diese Symptome sind vor allem bei Schafen zu beobachten, können jedoch auch bei Ziegen und Rindern auftreten. Bei trächtigen Kamelen können auch Aborte auftreten, die Tiere erkranken aber meist klinisch inapparent. Eine Ausnahme konnte jedoch in Mauretanien beobachtet werden, wo Kamele innerhalb weniger Tage an hämorrhagischen Symptomen verstorben sind. Der Großteil der Menschen entwickelt Grippe-ähnliche Symptome wie Kopf- und Gliederschmerzen und Fieber. Die Inkubationszeit beträgt in der Regel 4-6 Tage. Bei 1-2% der humanen Fälle können jedoch auch schwere bis tödliche Verläufe entstehen. Dabei können vor allem Symptome einer schweren Hepatitis (wie auch beim Tier) beobachtet werden, wodurch ein hämorrhagisches Fieber entstehen kann, bei dem es zu blutigem Urin/ Stuhl, Erbrechen und Einblutungen im Gewebe kommen kann. Dieser Verlauf kann innerhalb einer Woche tödlich enden. Neben der hämorrhagischen Form, gibt es aber auch einen neurologischen Verlauf beim Menschen, der Tage bis Wochen nach der febrilen Phase auftreten und zu einer Encephalitis führen kann. Typische Symptome sind Halluzinationen, Desorientierung, Schwindel und Paralysen. Auch dieser Verlauf kann tödlich enden oder zu einer dauerhaften Hemiparese führen. Ein schwerer Rifttalfieberverlauf geht oftmals mit einem hohen Virustiter im Blut einher. Interessanterweise zeigen Labormäuse sowohl den Verlauf einer schweren Hepatitis als auch den Neurologischen, weshalb sie ein gutes Tiermodell für humane antivirale und Vakzine Studien sind. Abschließend gibt es Studien, dass es bei 10% aller RVFV Infektionen (unabhängig des Schweregrades) zu Einschränkungen im Sehbereich kommen kann. Symptome wie Lichtempfindlichkeit oder generelle Sehstörungen treten dabei vor allem aufgrund einer Uveitis, Retinitis und/oder Einblutungen im Augenbereich auf. Diese treten in der Regel 1-3 Wochen nach der ursprünglichen Erkrankung auf und können Wochen, Monate oder teilweise dauerhaft anhalten. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Aktuell gibt es nur für Tiere teilzugelassene Impfstoffe (z.B. Smithburn Vakzine, Clone-13, MP-12), welche nur in Endemiegebieten eingesetzt werden dürfen. Dies liegt vor allem daran, dass es sich bei diesen um attenuierte Lebendvakzinen handelt und Studien zeigen, dass sie immer noch vereinzelt in trächtigen Tieren zu Aborten führen können, weshalb eine Impfung trächtiger Tiere meist kontraindiziert ist. Für Menschen gibt es keinen frei verfügbaren Impfstoff. Für das US-Militär wurde der mit Formalin inaktivierte Impfstoff TSI-GSD 200 entwickelt. Dieser benötigt jedoch 3 Immunisierungen und einen zusätzlichen Boost nach 6 Monaten. Derzeit sind keine antiviralen Mittel für eine RVFV Infektion auf dem Markt verfügbar, weshalb die Behandlung symptomatisch erfolgt. Ribavirin wurde aufgrund des Gebrauchs bei anderen hämorrhagischen Erregern in dem ersten Ausbruchsgeschehen auf der Arabischen Halbinsel eingesetzt, jedoch wurde der Einsatz aufgrund adverser Reaktionen abgebrochen. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
In betroffenen Gebieten werden regelmäßige Beprobungen von Wiederkäuern und Kamelen, aber auch von Wildtieren durchgeführt und serologisch und molekularbiologisch untersucht, um beispielsweise ein akutes Infektionsgeschehen frühzeitig zu detektieren oder den Grad der Durchseuchung zu bestimmen. Da RVFV Ausbrüche vor allem mit starken Niederschlägen und dem Massenschlupf von Mücken einhergehen, werden auch die klimatischen Bedingungen und Vektorpopulationen überwacht, um bei solchen Events schnell reagieren zu können. Außerdem gibt es immer mehr Screenings in angrenzenden Regionen, um mögliche Ausbreitungen des Erregers frühzeitig erkennen zu können. Zusätzlich ist das Rifttalfiebervirus ein gelisteter Erreger der OIE. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Zum einem ist, wie bereits oben erwähnt, immer noch nicht bekannt, ob und welches Reservoir RVFV hat. Somit gibt es nach wie vor Untersuchungen sowohl im Feld als auch im Labor, um einen möglichen Vertebraten identifizieren zu können. Dafür gab es beispielsweise in jüngster Vergangenheit Infektionsversuche mit Hausratten, Reptilien und Amphibien oder auch Blutmahlzeituntersuchungen von Mücken aus endemischen Regionen, die vor kurzem Blut gesaugt hatten. Zum anderen gibt es nach wie vor keinen zugelassenen Impfstoff in der Humanmedizin und nur Veterinärvakzinen, die in Endemiegebieten zugelassen sind und zudem immer noch ein Restrisiko für Aborte aufweisen. Zudem gibt es keine zuverlässigen antiviralen Mittel als Therapieansatz. Daher ist es nicht verwunderlich, dass es zahlreiche Projekte gibt, die vor allem das Ziel haben, wirksame und sichere Impfstoffe für Human- und Veterinärmedizin zu etablieren. Auch gibt es zahlreiche Untersuchungen für Therapieansätze wie beispielsweise der Einsatz monoklonaler Antikörper. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Schon in der Erstbeschreibung wurde erkannt, dass der Ausbruch im Zusammenhang mit den Mücken steht. So wurden die verbliebenen Tiere in ein höher gelegenes Gebiet getrieben und es kam daraufhin zu einer Reduktion der Fälle. Somit ist die Vektorenbekämpfung ein essentieller Punkt, weshalb der Einsatz von Repellentien wichtig für die Prävention von RVFV und anderen Vektor-übertragenden Erkrankungen ist. Auch die meteorologische Überwachung spielt dabei eine wichtige Rolle. So ist bekannt, dass bei starken, andauernden Niederschlägen aufgrund des Massenschlupfs Ausbrüche bevorstehen können, wodurch Landwirte sich darauf vorbereiten können und beispielsweise, wenn möglich, die Tiere in vektorarme Regionen treiben und sie impfen können. Daher ist auch der Einsatz der bisher verfügbaren Veterinärimpfstoffe wichtig. So sollte, wie bereits erwähnt, zwar darauf geachtet werden, dass trächtige Tiere nicht geimpft werden, aber dafür ist die Impfung der restlichen Herde umso wichtiger. Zudem sind regelmäßige Screenings und Surveillanceprogramme eine wichtige Bekämpfungsstrategie, um Ausbrüche frühzeitig zu erkennen und mit Notimpfungen die Ausbreitung eindämmen zu können. Zum anderen sind jedoch auch klassische Keulungen effektiv um die Ausbreitung zu verhindern. |
|
Wo liegen zukünftige Herausforderungen? |
|
Wie bei vielen anderen Vektor-übertragenden Erkrankungen bieten der Klimawandel, aber auch die Globalisierung eine große Chance für RVFV sich weiter ausbreiten zu können. So gibt es bereits jetzt zahlreiche Studien über viele, in anderen Ländern heimische Vektoren (unter anderem auch deutsche Mückenpopulationen), die potentiell dazu fähig sind RVFV übertragen zu können. Daher sind weitere umfangreichere Surveillanceprogramme in den endemischen, aber auch angrenzenden Regionen notwendig. Denn zum einem ist es wichtig zu sehen, ob es zu einer weiteren Ausbreitung in bislang nicht betroffenen Ländern kommt. Zum anderem ist nach wie vor auch die Aufklärung über das Vorkommen und die Verbreitung des Virus in endemischen Regionen für die Eindämmung essentiell. Nicht umsonst zählt RVFV zu den sogenannten „neglected tropical diseases“. So müssen vor allem Landwirte, Veterinäre und weitere Personengruppen, die unmittelbar bei Ausbrüchen betroffen sind, für diesen teilweise immer noch wenig bekannten Erreger sensibilisiert werden, damit diese wissen, wie sie bei einem Ausbruch handeln müssen und somit sowohl sich selbst als auch die Tiere schützen können. Auch die Frage des möglichen Reservoirs spielt mit in diese Punkte rein. So gäbe es weitere Angriffspunkte für die Eindämmung, wenn der vollständige Replikationszyklus mit Reservoir bekannt wäre. Abschließend ist es vor allem wichtig, sowohl einen wirksamen und sicheren Veterinär- als auch Humanimpfstoff zu entwickeln, der auch außerhalb endemischer Gebiete zugelassen werden kann. |
Für die fachliche Unterstützung bei der Erstellung des RVFV-Steckbriefes danken wir Dr. Benjamin Gutjahr vom Institut für neue und neuartige Tierseuchenerreger, Friedrich-Loeffler-Institut, Greifswald – Insel Riems.
März 2022 - Borna disease virus 1 (BoDV-1)

Abbildung: Die Feldspitzmaus (Crocidura leucodon) ist als Reservoir des Borna disease virus 1 (BoDV-1) bekannt. Bild: Friedrich-Loeffler-Institut, Fotograf: H. Vierhaus
|
Beschreibung |
|
Das Borna disease virus 1 (BoDV-1) ist ein behülltes Negativ-Strang RNA-Virus aus der Familie der Bornaviridae. Bei einer großen Bandbreite von Säuger-Spezies kann es persistierende Infektionen etablieren. Das Virus ist nicht zytolytisch (zellauflösend), besitzt aber dennoch große Bedeutung als Erreger zumeist tödlicher Enzephalitiden bei Haustieren und Menschen, die Folge einer Immunpathogenese sind. |
|
Erstmals entdeckt |
|
Das Krankheitsbild der Borna´schen Krankheit wurde bereits im 19. Jahrhundert bei Pferden im Süden und Osten Deutschlands beschrieben. Das Virus selbst wurde erstmals in den 1920er Jahren isoliert, jedoch erst in den 1990er Jahren als Negativ-Strang RNA-Virus klassifiziert. Das zoonotische Potential des Erregers konnte erst im Jahr 2018 durch die Veröffentlichung zweifelsfrei bestätigter Infektionen bei Patienten mit tödlichen Enzephalitiden nachgewiesen werden. |
|
Wo kommt der Erreger vor? |
|
Nach heutigem Wissensstand hat das BoDV-1 ein sehr begrenztes Verbreitungsgebiet, dass sich in Deutschland auf Bayern, Thüringen, Sachsen und Sachsen-Anhalt, Brandenburg sowie z.T. Regionen in angrenzenden Bundesländern beschränkt. Hinzu kommen begrenzte Gebiete in der Schweiz, Österreich und Liechtenstein. |
|
Betroffene Tierspezies, Reservoir |
|
Das Reservoir des BoDV-1 bilden Spitzmäuse der Gattung Crocidura, vor allem die Feldspitzmaus (Crocidura leucodon, siehe Abbildung). Bei ihnen etabliert das Virus persistente Infektionen mit Verbreitung im gesamten Organismus und Virusausscheidung, ohne dass es zu einer Erkrankung kommt. Bei Übertragung auf andere Säugetierspezies (incl. des Menschen) ist BoDV-1 jedoch aufgrund seiner fehlenden Anpassung streng neurotrop und fast ausschließlich im Gehirn zu finden. Als Folge einer von T-Lymphozyten vermittelten Immunpathogenese kommt es zu einer in den meisten Fällen tödlichen Enzephalitis. Generell scheinen die meisten Säugetiere empfänglich für die Infektion zu sein. Am häufigsten werden Fälle bei Pferden, Schafen, Neuweltkameliden (z.B. Alpakas) und Menschen beschrieben. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Epidemiologische Studien deuten darauf hin, dass es sich bei der Mehrzahl der zoonotischen Infektionen des Menschen um voneinander unabhängige Übertragungsereignisse aus dem Reservoir handelt (sog. „spill-over“). Der genaue Übertragungsweg von der Spitzmaus auf den Menschen ist noch unbekannt. Experimentelle Studien bei verschiedenen Tierarten haben gezeigt, dass die Infektion über die Riechschleimhaut erfolgen kann. Aber auch andere mögliche Übertragungswege, z.B. über Hautwunden, können nicht ausgeschlossen werden. Fast alle bisher nachgewiesenen Fälle traten in ländlichen Räumen innerhalb der bekannten Endemiegebiete des Virus auf. Infizierte Menschen, ebenso wie andere Nicht-Reservoirwirte, scheiden das Virus nicht aus und können es nicht auf andere Individuen übertragen. Die einzige Ausnahme bildet ein Fall einer Übertragung im Rahmen einer Organtransplantation von einem infizierten Spender auf drei Organempfänger. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Das bei infizierten Nicht-Reservoirwirten auftretende Krankheitsbild ist bei Menschen und Tieren sehr ähnlich. Die Erkrankung beginnt oft mit Fieber und starken Kopfschmerzen. Gefolgt wird sie von Verhaltensauffälligkeiten, Koordinationsstörungen, Krampfanfällen und gelegentlich Sehstörungen. Beim Menschen kommen Sprachstörungen hinzu. Innerhalb weniger Tage bis einiger Wochen kommt es in der Regel zum Koma und Tod der Infizierten. Nur wenige Betroffene überleben eine Erkrankung, dann jedoch meist mit schweren bleibenden Schäden. Ob und in welchem Umfang es mildere oder sogar asymptomatische Verläufe der Infektion gibt, ist bisher noch weitgehend ungeklärt. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Bisher gibt es weder eine etablierte Therapie noch einen Impfstoff. Für die antiviralen Wirkstoffe Ribavirin und Favipiravir wurde eine Wirksamkeit gegen Bornaviren in Zellkultur nachgewiesen. Belastbare Erfahrungen für den Einsatz bei Menschen und Tieren stehen jedoch noch aus. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Seit März 2020 sind Bornavirusinfektionen sowohl beim Menschen als auch bei Säugetieren in Deutschland meldepflichtig. Dadurch hat sich die Datenlage zum Vorkommen des Virus deutlich verbessert. Zudem haben die Veröffentlichungen und die mediale Berichterstattung zu den menschlichen Infektionsfällen die Aufmerksamkeit für die Erkrankung deutlich erhöht. Dennoch muss davon ausgegangen werden, dass sowohl in der Human- als auch in der Veterinärmedizin noch immer ein beträchtlicher Teil der Fälle unerkannt bleibt. Dies hängt auch damit zusammen, dass die Infektion beim lebenden Patienten nicht immer sicher nachweisbar ist und dass die sichere Diagnostik daher oft eine Obduktion oder zumindest eine Biopsie vom Gehirn des Patienten erfordert. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Im Rahmen des ZooBoCo beschäftigen wir uns unter anderem mit Fragen zur Pathogenese, dem Wirtspektrums, der Verbreitung des Virus bei Reservoir- und Nicht-Reservoirwirten sowie den Übertragungswegen des BoDV-1. Im Zentrum der Forschung stehen außerdem die Identifikation antiviraler Wirkstoffe ebenso wie die Verbesserung der Diagnostik insbesondere beim lebenden Individuum. Neben dem BoDV-1 arbeiten wir auch an eng verwandten Viren, wie z.B. dem Bunthörnchen-Bornavirus (variegated squirrel bornavirus 1, VSBV-1), einem weiteren zoonotischen Bornavirus, dass beim Menschen ebenfalls tödliche Enzephalitiden hervorrufen kann. Zudem befassen wir uns mit der Suche nach neuen, bisher noch unentdeckten Bornaviren. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Aufgrund der fehlenden Möglichkeiten zur Impfung oder post-exponentiellen Therapie beschränkt sich die Bekämpfung weitgehend auf die Verhinderung der Exposition zu potentiell infizierten Reservoirwirten und ihren Ausscheidungen. Dazu zählt insbesondere in Gebieten, in denen das Virus endemisch ist, die Spitzmäuse von menschlichen Behausungen und Tierställen fernzuhalten. Das Robert Koch-Institut hat dazu ein Merkblatt erstellt. |
|
Wo liegen zukünftige Herausforderungen? |
|
Wie bereits in den Forschungsschwerpunkten erwähnt, bedarf es für die zukünftige Bekämpfung der Erkrankung der Aufklärung der Übertragungswege und der Entwicklung von Therapiemöglichkeiten. Zudem sollte der Einfluss des Klimas auf die Populationen der Reservoirwirte des BoDV-1 und ggf. auch auf die Transmissionsraten im Auge behalten werden. Bezogen auf die Mitglieder der Familie Bornaviridae im Allgemeinen wird ein besseres Verständnis ihres Vorkommens bei Säugetieren weltweit benötigt, um zukünftige Risiken zoonotischer Übertragungen besser einschätzen zu können. |
|
Sonstiges |
| In der Vergangenheit war über eine weltweite Verbreitung von BoDV-1 bei Menschen und Tieren sowie über einen Zusammenhang mit psychiatrischen Krankheitsbildern berichtet worden. Diese Vermutungen ließen sich jedoch nicht wissenschaftlich belegen und gelten inzwischen als widerlegt. |
Für die fachliche Unterstützung bei der Erstellung des BoDV-1-Steckbriefes danken wir PD Dr. Dennis Rubbenstroth und Kolleg*innen vom Institut für Virusdiagnostik, Friedrich-Loeffler-Institut, Greifswald – Insel Riems.
Februar 2022 - nicht-typhoidale Salmonellen
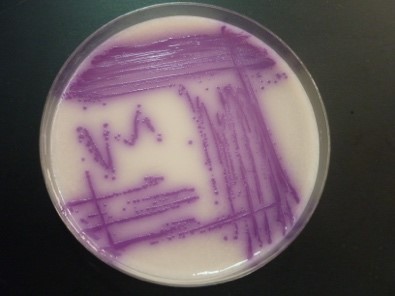
Abbildung: Salmonella enterica auf Chromagar (Oxoid Ltd., Basingstoke, UK), Foto: D. Dekker, BNITM
|
Beschreibung |
|
|
Nicht-typhoidale Salmonellen (NTS), auch enterische Salmonellen genannt, sind gramnegative, peritrich begeißelte, stäbchenförmige Bakterien aus der Familie der Enterobakterien. Unter den 2500 Serovaren sind über 500 nachweislich humanpathogen. Weltweit werden die meisten Infektionen durch die Serovare Enteritidis und Typhimurium verursacht. NTS sind an die Vermehrung sowohl im Gastrointestinaltrakt von Menschen als auch von Tieren hoch adaptiert. Sie kommen unter anderem im Magen-Darm-Trakt von Tieren wie z.B. Säugetieren, Reptilien, Vögeln und sogar Insekten vor. |
|
|
Erstmals entdeckt |
|
|
Im Jahr 1885 entdeckte Theobald Smith, ein Forschungsassistent von Daniel Elmer Smith, nach dem die Gattung benannt wurde, erstmals Salmonella Choleraesuis („Schweinecholera“-Bakterien). 1888 gelang es August Gärtner, den Verursacher der „Fleischvergiftung“ und damit einen Erreger der Salmonellen-Enteritis zu identifizieren, früher bekannt als „Bacillus enteritidis Gärtner“, heute Salmonella Enteritidis. Zwischen 1888 und 1892 beschrieb Friedrich Loeffler im Rahmen einer Mäusetyphus-Epidemie bei Versuchsmäusen das auch humanpathogene Serovar Salmonella Typhimurium. |
|
|
Wo kommt der Erreger vor? |
|
|
Salmonellen im Menschen sowie im Tierreservoir sind weltweit verbreitet. Sie kommen sowohl in Nutztieren wie Geflügel, Schweinen und Rindern wie auch in Haustieren, einschließlich Katzen, Hunden, Vögeln und Reptilien vor. Salmonellen werden häufig mit tierischem Lebensmittel assoziiert und können die gesamte Nahrungskette bis hin zu Haushalten oder gastronomischen Einrichtungen und Institutionen durchlaufen. Auch pflanzliche Lebensmittel können mit Salmonellen besiedelt sein. Des Weiteren können sie in der Umwelt mehrere Wochen, unter Umständen sogar Monate, persistieren (im Wasser, Boden, etc.). |
|
|
Betroffene Tierspezies, Reservoir |
|
|
Das Hauptreservoir der gastroenterischen Salmonellen sind Tiere. Diese erkranken jedoch selbst nur selten an einer Salmonellose. Es handelt sich hier primär um landwirtschaftliche Nutztiere wie Rinder, Schweine und Geflügel und daraus erzeugte tierische Lebensmittel. Salmonellen kommen jedoch auch im Magen-Darm-Trakt vieler anderer Tiere, wie z.B. in Reptilien, Wildtieren, Vögeln und Insekten vor. Studien zeigen, dass Salmonellen hoch adaptiv sind und sich an ihre Umgebung oder an ihren Wirt anpassen. Auch der Mensch bietet ein optimales Habitat für Salmonellen. In Industrieländer sind Erkrankungen mit Salmonellen eine typische Lebensmittelinfektion, die mit selbst-limitierendem Durchfall einhergeht. Menschen können Salmonellen über mehrere Wochen mit dem Stuhl nach einer Infektion ausscheiden und dienen somit auch als Erregerreservoir. In Entwicklungsländer dagegen, insbesondere im subsaharischen Afrika, sind NTS häufige Sepsis-Erreger. Der Übertragungsweg und das Erregerreservoir solcher invasiven Stämme gilt, im Gegensatz zu den Durchfall-verursachenden Bakterien, als ungeklärt. Eine anthroponotische Übertragung ist denkbar und wird derzeit untersucht. |
|
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
|
Zur Risikogruppe einer solchen Infektion zählen vor allem ältere Menschen, Kleinkinder und Immungeschwächte. Bei Gesunden schützt die intakte Darmflora meistens vor schweren Verläufen. Infektionen erfolgen durch orale Erregeraufnahme. Das in Deutschland vorherrschende Serovar Enteritidis wird überwiegend über nicht ausreichend erhitzte eihaltige Speisen übertragen. Durch die Einführung einer Impfung gegen Salmonellen bei Geflügel kam es seit 2008 zu einer drastischen Abnahme von menschlichen Erkrankungen durch S. Enteritidis. Das ähnlich häufig in Deutschland vorkommende Serovar Typhimurium wird häufig durch rohes Fleisch oder nicht ausreichend erhitzte Fleischerzeugnisse übertragen. Zugleich werden immer wieder pflanzliche Lebensmittel mit der Übertragung von Salmonellen in Verbindung gebracht. Auch primär nicht mit Salmonellen kontaminierte Lebensmittel können durch die Berührung infizierter Menschen, Kontakt mit kontaminierten Oberflächen oder mit kontaminierten anderen Lebensmitteln zum Infektionsrisiko werden. In Deutschland wurden Salmonellen in verschiedenen Ausbrüchen u.a. mit dem Verzehr von Kräutertee und Schokolade in Zusammenhang gebracht. Durch direkten Kontakt mit Salmonellen ausscheidenden Tieren erfolgt äußerst selten eine Übertragung auf den Menschen. Dieser Übertragungsweg ist jedoch bei Heimtieren nachgewiesen, insbesondere bei der Haltung von Reptilien. Eine besondere Infektionsgefährdung von Säuglingen und Kleinkindern auf diesem Weg wurde mehrfach beschrieben. Die Infektionsdosis für den erwachsenen Menschen liegt bei 104–106 Bakterien. Befinden sich Salmonellen in stark fetthaltigen Lebensmitteln, in Gewürzen oder besteht eine besondere Disposition, z.B. eine Abwehrschwäche wie bei Säuglingen, Kleinkindern oder alten Menschen, sind Erkrankungen bereits bei Infektionsdosen unter 102 Bakterien möglich. |
|
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
|
Die Salmonellose manifestiert sich häufig als akute Darmentzündung mit plötzlich einsetzendem Durchfall, Kopf- und Bauchschmerzen sowie Erbrechen. Die Symptome halten oft über mehrere Tage an. Bei Kleinkindern oder älteren Erwachsene kann die resultierende Dehydrierung stark ausgeprägt sein. Die Beschwerden verschwinden je nach Schwere der Infektion in der Regel nach einigen Stunden oder Tagen von selbst. Eine antibiotische Therapie wird in diesen Fällen nicht empfohlen. In seltenen Fällen (ca. 5%) kann die initiale Darmentzündung einen septischen Verlauf nehmen. |
|
|
Gibt es Medikamente oder einen Impfstoff? |
|
|
Eine antimikrobielle Therapie wird bei leichten oder mittelschweren Verläufen, außerhalb der genannten Risikogruppen, nicht empfohlen. Bei sonst gesunden Menschen mit einer Salmonelleninfektion verkürzen Antibiotika im Allgemeinen nicht die Dauer der Infektion. Antibiotika können in diesem Fall zur Störung des Mikrobioms wie auch zu einer verlängerten Erregerausscheidung führen. Bei schweren Verläufen wird eine antimikrobielle Therapie empfohlen. Zu den eingesetzten Antibiotika gehören Fluorochinolone und Cephalosporine der dritten Generation. Gegenwärtig gibt es keinen zugelassenen Impfstoff für Menschen. Derzeit befinden sich Impfstoffe gegen die Serovare Enteritidis und Typhimurium in der klinischen Phase 1 bis 2. Hingegen, gibt es verschiedene zugelassene Salmonellen Impfstoffe für Nutztiere. |
|
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
|
Um Infektionsketten zu durchbrechen, besteht In Deutschland eine Meldepflicht beim zuständigen Gesundheitsamt. Die Europäische Behörde für Lebensmittelsicherheit (EFSA) sowie das Europäische Zentrum für die Prävention und die Kontrolle von Krankheiten (ECDC) erheben und werten jährlich Daten zur Salmonellen-Prävalenz beim Menschen und in der Lebensmittelproduktionskette aus. In Deutschland sind in den Programmen zur Überwachung von Zoonosen wie Salmonellen und von Antibiotikaresistenzen sowohl die Veterinärbehörden als auch die Gesundheitsämter beteiligt. Informationen werden beim Robert Koch-Institut und beim Bundesinstitut für Risikobewertung gesammelt. |
|
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
|
|
Welche Bekämpfungsstrategien gibt es? |
|
|
Zur Bekämpfung der Salmonellose beim Menschen ist es wichtig, den Befall von Tieren und daraus gewonnenen Produkten mit Salmonellen zu vermindern, damit die Lebensmittel für den Verbraucher sicherer werden. Küchenhygiene sowie klar definierte Regeln für den Umgang mit Lebensmitteln sollten eingehalten werden. Hierzu zählen etwa das sofortige Kühlstellen von Lebensmitteln; regelmäßiges Händewaschen und Reinigen von Arbeitsflächen, Schneidbrettern und sonstigen Küchenutensilien; das Getrennthalten von rohem Fleisch und anderen Lebensmitteln; sowie ausreichendes Durchgaren von Lebensmitteln. Salmonellen können die gesamte Nahrungskette von der Primärproduktion (= der Pflanzenanbau und die Aufzucht und Haltung von Nutztieren) bis hin zu Haushalten oder gastronomischen Einrichtungen über vital bleiben. Daher ist es wichtig, Einträge aus der Primärproduktion in die Lebensmittelproduktionskette zu vermeiden. Dazu gibt es in Deutschland auch verschiedene Nutztier- Salmonellenverordnungen (z.B. Geflügel-Salmonellen-Verordnung, Schweine-Salmonellenverordnung). |
|
|
Wo liegen zukünftige Herausforderungen? |
|
|
Auch zukünftig wird die Zunahme von Antibiotikaresistenzen ein großes Problem darstellen, was mit schwer zu behandelten Infektionen einhergeht. Besonders betroffen sind Entwicklungsländer, mit geringfügigen Ressourcen und einer begrenzten Auswahl an Antibiotika. Internationales Reisen wird ferner dazu beitragen, dass „exotische“ Serovare wie auch multiresistente Erreger potentiell weltweit vorkommen und sich verbreiten können. Salmonellen passen sich an die jeweilige Umgebung an, sei es an die Fauna oder hinsichtlich ihrer Wachstumseigenschaften, zum Beispiel an geänderte Temperatur- und sonstige Umweltbedingungen. Sie sind wahre Anpassungskünstler! |
|
|
Sonstiges |
|
|
Quellen und weiterführende Informationen: https://www.who.int/news-room/fact-sheets/detail/salmonella-(non-typhoidal) https://www.cdc.gov/salmonella/general/technical.html https://www.bfr.bund.de/de/bedeutung_der_salmonellen_als_krankheitserreger-537.html |
Für die Erstellung des Steckbriefes zu Salmonellen danken wir Dr. Denise Dekker, Andrea Molina und Kerstin Shand vom Bernhard Nocht Institut für Tropenmedizin in Hamburg.
Januar 2022 - Influenzaviren
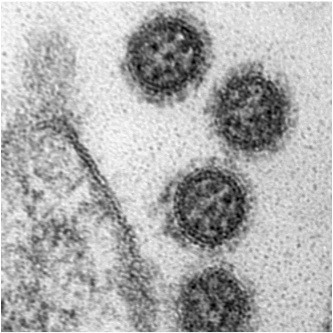
Abbildung: Transmissionselektronenmikroskopische Aufnahme von Influenza A Virus-Partikeln in Zellkultur. Copyright: Institut für Virologie Münster, image credit: Lilo Greune.
|
Beschreibung |
|
Influenzaviren gehören zur Familie der Orthomyxoviridae, die neben den Isa-, Quaranja- und Thogotoviren vier Genera von Influenzaviren aufweist (Alpha, Beta, Gamma und Delta). Jede dieser Gattungen enthält nur eine Spezies, die entsprechend Influenzavirus A, B, C und D genannt werden. Für den Menschen sind die saisonal auftretenden Influenza A und B Viren besonders relevant. Influenzaviren des Typs A werden anhand ihrer Oberflächenantigene in Subtypen unterteilt (z.B. HxNx), während man im Falle der Influenza B Viren lediglich zwei genetisch unterschiedliche Linien (Yamagata-Linie und Victoria-Linie) unterscheidet. Influenzaviren gehören zu den umhüllten Viren und besitzen ein einzelsträngiges, segmentiertes RNA-Genom mit negativer Polarität. |
|
Erstmals entdeckt |
|
Das Influenza A Virus wurde erstmals 1933 von Wilson Smith, Christopher Andrewes und Patrick Laidlaw isoliert. 1936 folgte das Influenza B Virus, 1947 Influenza C Viren und als letzte Spezies wurden 2011 die Influenza D Viren identifiziert. |
|
Wo kommt der Erreger vor? |
|
Generell sind Influenzaviren weltweit verbreitet. Es lässt sich eine wechselnde unterschiedliche Verteilung der verschiedenen Influenza A Virus Subtypen je nach Region feststellen. In gemäßigten Zonen der nördlichen und südlichen Hemisphäre treten regelmäßig in den jeweiligen Wintermonaten Grippewellen auf, wohingegen in tropischen Ländern die Influenza ganzjährig beobachtet wird. |
|
Betroffene Tierspezies, Reservoir |
|
Influenzaviren weisen ein breites Wirtsspektrum auf, darunter Menschen, Schweine, Pferde, Robben, Hunde, verschiedene Wasservögel, Seevögel und Wirtschaftsgeflügel. Zoonotische Erkrankungen werden nur durch Influenza A Viren hervorgerufen, deren natürliches Reservoir Wasser- und Zugvögel, insbesondere jedoch Wildenten darstellen. Die Ansicht, dass Wasservögel das alleinige ursprüngliche Wirtsreservoir für alle bekannten Influenza A Virus Subtypen sind, wurde jedoch in Frage gestellt, als 2012 ein neuer Influenzavirusstamm in Fledermäusen in Guatemala nachgewiesen wurde. Obwohl Influenzaviren grundsätzlich sehr gut an ihren jeweiligen Wirt angepasst sind, werden immer wieder Interspezies-Übertragungen beobachtet. Hierbei spielen insbesondere Schweine eine große Rolle, die als klassische Mischgefäße gelten, da sie sich mit Vogel-, Menschen- und Schweine-Influenzaviren anstecken können. Neuartige humane Influenzaviren können durch Adaptation eines zoonotischen Influenzavirus an den Menschen oder durch den Austausch von Genomsegmenten zoonotischer und humaner Influenzaviren entstehen. Dieser Vorgang wir als „Reassortment“ bezeichnet und ist bei der Entstehung von Pandemien von besonderer Bedeutung. Im Gegensatz dazu gilt der Mensch als das einzige Reservoir für die saisonale Influenza. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Influenzaviren werden über Aerosole von Mensch zu Mensch übertragen, zum Beispiel beim Reden, Husten oder Niesen. Darüber hinaus ist eine Übertragung auch durch direkten Kontakt der Hände zu Oberflächen, die mit virushaltigen Sekreten kontaminiert sind, möglich (z.B. durch Händeschütteln). Derzeit zirkulieren vorrangig Influenza A Viren der Subtypen H3N2 und H1N1, sowie Influenza B Viren der Yamagata- und Victoria-Linien. Eine Übertragung von aviären Influenzaviren kann bei engem Kontakt zu infiziertem, erkranktem oder totem Geflügel oder zu mit Geflügelausscheidungen kontaminierter Umgebung erfolgen. Diese Übertragungen sind jedoch sehr selten und vermutlich mit der Aufnahme sehr großer Virusmengen verbunden. Einen eindeutigen Nachweis einer fortgesetzten Mensch-zu-Mensch Übertragung dieser Viren hat es bisher jedoch noch nicht gegeben. Auch ein direkter Kontakt zu Schweinen kann zu einer Übertragung porciner Influenzaviren führen, die in Ausnahmefällen auch von Mensch zu Mensch übertragen wurden. Als Risikogruppen gelten Personen, die älter als 65 oder jünger als 5 Jahre sind, Schwangere, chronisch Erkrankte oder Immunsupprimierte, wobei bei schweren Verläufen bakterielle Superinfektionen häufig eine Rolle spielen. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Influenzaviren lösen bei Menschen und Tieren die sogenannte „Influenza/Grippe“ aus, eine respiratorische Krankheit, die mit hohem Fieber, Husten, Halsschmerzen und laufender Nase einhergeht. Weitere Symptome sind Kopf- und Gliederschmerzen, allgemeine Erschöpfung und Appetitlosigkeit. In Vögeln induzieren Influenzaviren in der Regel asymptomatisch verlaufende Infektionen, wobei die Viren sich in erster Linie im Intestinaltrakt vermehren. Eine Besonderheit stellen Infektionen mit den Subtypen H5 und H7 dar, die eine systemische Infektion verursachen und die sogenannte „Geflügelpest“ hervorrufen. Diese schreitet nach einer kurzen Inkubationszeit schnell voran und endet für die betroffenen Tiere meist tödlich. Aviäre Influenzaviren können im Menschen schwere grippeähnliche Symptome sowie Durchfall und Erbrechen hervorrufen. Im weiteren Verlauf der Erkrankung entwickelt sich meist eine Lungenentzündung, die zu Lungenversagen und Tod führen kann. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt eine Reihe zugelassener antiviraler Medikamente, die allerdings für gewöhnlich nur bei besonders schwer Erkrankten zum Einsatz kommen, da Influenzaviren sehr schnell Resistenzen gegen diese entwickelt. Viele Wirkstoffe weisen nicht nur eine begrenzte Wirksamkeit auf, sondern sind gegen die aktuell zirkulierenden Influenzaviren bereits nicht mehr anwendbar. In den meisten Fällen wird statt einer antiviralen Therapie eine reine Symptombehandlung vorgenommen. Neben Medikamenten gibt es auch eine wirksame Impfung gegen Influenza A und B Viren. Durch die schnelle Evolution der Influenzaviren muss diese allerdings ständig angepasst werden. Zurzeit bestehen die Impfstoffe aus zwei Influenza A Viren sowie zwei Influenza B Viren, die von der WHO auf Grundlage der Daten zu aktuell zirkulierenden Viren jährlich neu festgelegt werden. Empfohlen wird der Impfstoff in Deutschland für Angehörige der Risikogruppen, sowie deren Kontaktpersonen, einschließlich medizinischem Personal. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Es gibt eine ganze Reihe nationaler und internationaler Überwachungssysteme, die dauerhaft Daten über aktuell zirkulierende Influenzavirusstämme sammeln und austauschen. Die meisten dieser Programme sind schon seit Jahrzehnten aktiv. An das Global Influenza Surveillance and Response System (GISRS) der WHO übermitteln zum Beispiel über 150 Labore in 126 Ländern ihre Daten. Es existieren gesonderte Programme, deren Fokus auf der Verhinderung und Eindämmung von Pandemien liegt. Zur Kontrolle der Vogelgrippe wird in Deutschland jährlich ein Wildvogel-Geflügelpest-Monitoring durchgeführt. Außerdem unterliegen die niedrigpathogene aviäre Influenza bei Wildvögeln und Fälle von Geflügelpest der Melde- bzw. Anzeigepflicht. Im Gegensatz dazu besteht für die Influenza der Schweine in Deutschland und Europa derzeit keine gesetzliche Melde- oder Anzeigepflicht. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
Welche Bekämpfungsstrategien gibt es? |
|
Neben allgemeinen Hygienemaßnahmen ist die Impfung zurzeit die wirksamste Bekämpfungsstrategie gegen Influenzaviren. Auch in Schweinen ist die Influenza-Impfung die vorrangige vorbeugende Maßnahme, es sind verschiedene inaktivierte Adjuvant-Impfstoffe europaweit zugelassen. Im Gegensatz dazu ist eine Impfung von Geflügel kontraindiziert, da sie keine sterile Immunität induzieren würde, sondern lediglich zu symptomlosen Infektionen führt, während das Virus weiterverbreitet wird. Im Seuchenfall werden alle Tiere des Bestandes getötet. |
|
Wo liegen zukünftige Herausforderungen? |
|
Die zunehmende globale Mobilität führt auch zu einer steigenden Mobilität verschiedener Influenzaviren. Dabei spielt nicht nur die Mobilität des Menschen eine Rolle, sondern zum Beispiel auch der Transport lebender Tiere, vor allem von Geflügel und Schweinen. Anwachsende Bestände dieser Tierarten, die zum Teil in großer Zahl auf kleinem Raum leben, bieten Ideale Umstände für die Verbreitung und stellen ein großes potenzielles Risiko für die Bildung neuer Zoonosen dar. Insgesamt ist damit zu rechnen, dass das Risiko für Influenzapandemien weiter zunehmen wird und die globalen Anstrengungen zu ihrer Vermeidung und Bekämpfung entsprechend ausgebaut werden müssen. |
Für die fachliche Unterstützung bei der Erstellung des Influenzavirus-Steckbriefes danken wir Marcel E. Friedrich und Dr. Yvonne Börgeling vom Institut für Virologie Münster (IVM) an der Westfälischen Wilhelms-Universität Münster, Deutschland.
Dezember 2021 - Highlights 2021
Wir danken allen Beteiligten für die fachliche Unterstützung bei der Erstellung der zahlreichen Erregersteckbriefe!
November 2021 - Lassavirus
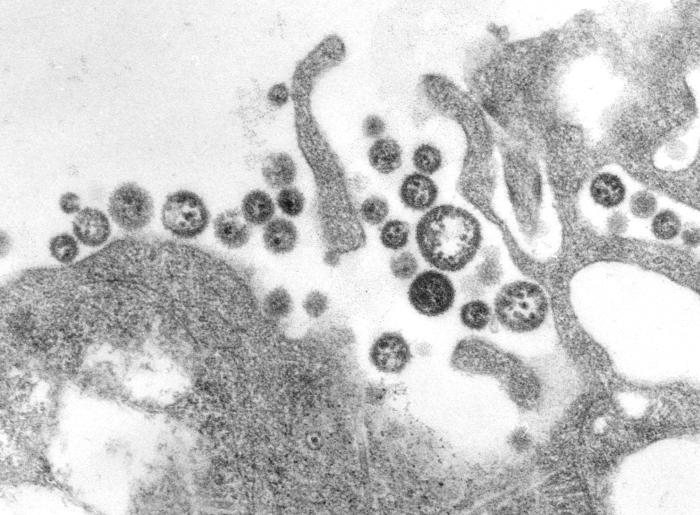
Abbildung: Transmissionselektronenmikroskopische Aufnahme von Lassavirus Partikeln in Zellkultur. Copyright: CDC‘s Public Health Image Library; Image #8700, Photo Credit: C. S. Goldsmith
|
Beschreibung |
|
Das Lassavirus (LASV) gehört zur Gattung der Mammarenaviren aus der Familie der Arenaviridae. Die Mammarenaviren werden weiter aufgrund phylogeographischer Eigenschaften unterschieden, wobei LASV zu den Alt-Welt Arenaviren gehört. Das behüllte Virus verfügt über ein einzelsträngiges, bi-segmentiertes RNA-Genom von negativer Polarität, welches aus einem großen (L) und einem kleinen (S) Segment besteht. Zurzeit werden mindestens 7 verschiedene genetische Linien des LASV unterschieden, welche eine Vielzahl an verschiedenen Virus-Stämmen umfassen. Das hochpathogene LASV ist gemäß der Biostoffverordnung als Erreger der Risikostufe 4 klassifiziert. |
|
Erstmals entdeckt |
|
Das LASV wurde zum ersten Mal 1969 in Lassa, Nigeria, beschrieben. Bei dem Ausbruch infizierten sich drei Krankenschwestern mit dem Virus, wobei zwei an den Folgen der Infektion verstarben. Kurz darauf wurde das Virus erfolgreich isoliert und als neuartiger Erreger identifiziert. |
|
Wo kommt der Erreger vor? |
|
LASV ist endemisch in verschiedenen Regionen West-Afrikas. Betroffene Länder sind v.a. Nigeria, Sierra Leone, Guinea und Liberia, aber auch in Mali, der Republik Côte d’Ivoire, Benin und Togo wurden vereinzelt Ausbrüche gemeldet. Vereinzelt kommt es auch zu importierten Fällen außerhalb Afrikas, diese sind jedoch nicht mit lokalen Ausbrüchen verbunden. |
|
Betroffene Tierspezies, Reservoir |
|
Wie die meisten Vertreter der Arenaviren wird auch LASV von Nagetieren übertragen. Das natürliche Wirtstier (Reservoir) ist die in Sub-Sahara weit verbreitete Natal-Vielzitzenmaus Mastomys natalensis. Dieses Nagetier lebt oft in engem Kontakt mit Menschen und ist v.a. in ländlichen Gegenden in der Nähe von Behausungen zu finden. Lange Zeit wurde davon ausgegangen das M. natalensis das einzige Wirtstier für LASV ist. In den letzten Jahren wurden jedoch zunehmend andere Nagetierspezies, wie z.B. die Afrikanische Waldmaus Hylomyscus pamfi, die Baoulei-Zwergmaus Mus baoulei, sowie die Guinea Vielzitzenmaus Mastomys erythroleucus, identifiziert, welche als weitere Reservoire dienen. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Menschen infizieren sich meist durch direkten oder indirekten Kontakt mit infizierten Wirtstieren oder deren Körperflüssigkeiten, beispielsweise durch den Verzehr von durch Urin kontaminierten Nahrungsmitteln. Auch werden Mastomys in betroffenen Regionen häufig gefangen und verzehrt. Eine direkte Mensch-zu-Mensch-Übertragung wurde zumeist in nosokomialen Ausbrüchen beobachtet, ist jedoch verhältnismäßig selten. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
In Menschen verursacht die Infektion mit LASV das sogenannte Lassafieber (LASF). Die Inkubationszeit beträgt 3 bis 21 Tage. Etwa 80 % der Infektionen im Menschen verlaufen asymptomatisch oder mit milden Verläufen. Symptome umfassen z.B. Fieber, generelles Unwohlsein, Kopfschmerzen, grippe-ähnliche Symptome und Beschwerden des Magen-Darm-Trakts. Durch das breite Spektrum an unspezifischen Manifestationen ist LASF oft kaum von anderen Fieber-Erkrankungen, wie Malaria, zu unterscheiden, was die Diagnose erschwert. Schätzungen zu Folge gibt es 100.000 bis 300.000 Fälle von LASF pro Jahr. Aufgrund der oft asymptomatischen bzw. milden Erkrankungen und der Verwechslungsgefahr mit anderen Fiebererkrankungen, sowie der zum Teil fehlenden Diagnostik-Infrastruktur in manchen Regionen, ist jedoch davon auszugehen, dass die tatsächliche Dunkelziffer höher liegt. Bei etwa 20 % der Infizierten kommt es zu einem schweren Verlauf, welcher tödlich enden kann und u.a. durch Symptome wie Blutungen, insbesondere der Schleimhäute, Schock und Atembeschwerden, gekennzeichnet ist. Darüber hinaus kann es auch zu neurologischen Komplikationen, wie Enzephalitis oder Gehörverlust kommen. Partieller oder kompletter Gehörverlust kann auch nach einer überstandenen Infektion anhalten und ist eine häufige Spätfolge in LASF-Überlebenden. Bei tödlichen Verläufen versterben Patienten meist innerhalb von zwei Wochen nach Auftreten erster Symptome in Folge von multiplem Organversagen. Die Sterblichkeitsrate von eingewiesenen Patienten in Krankenhäusern liegt bei etwa 15 %, sie kann während eines nosokomialen Ausbruchs jedoch höher sein. Für Schwangere entsteht durch LASF ein erhöhtes Risiko, da eine Infektion häufig zu Fehlgeburten führen kann und zusätzlich die Sterblichkeitsrate bei Schwangeren im dritten Trimester erhöht ist. Für das natürliche Wirtstier ist das LASV hingegen nicht pathogen. Infizierte Tiere entwickeln keine klinischen Symptome und werden durch die Infektion nicht beeinträchtigt. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Die gezielte Behandlung beschränkt sich bisher auf die off-label Gabe von Ribavirin, einem Breitband-Virostatikum. Die unterstützende Therapie durch Plasmatransfer von genesenen Patienten wurde bereits in mehreren Studien untersucht, erzielte jedoch widersprüchliche Erfolge. Zugelassene Impfstoffe gibt es bisher nicht, es befinden sich zurzeit aber 21 Impfstoffe in der präklinischen Erprobung. Diese umfassen inaktivierte Viruspartikel, sowie Virus-like-particle-basierte Ansätze. Aufgrund des Mangels an Therapeutika und Vakzinen verbleibt im Falle einer LASV Infektion oft nur die unterstützende Behandlung klinischer Symptome. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Die Diagnose von LASV Infektionen erfolgt für gewöhnlich durch die Detektion viraler RNA mit Hilfe von RT-PCR oder serologisch via Enzyme-linked Immunosorbent Assay. Das Überwachungssystem für LASV ist in endemischen Gebieten regional uneinheitlich. Im Großen und Ganzen wurden die Diagnostik-Kapazitäten und Infrastruktur in betroffenen Ländern in den letzten Jahren jedoch stark ausgebaut. Darüber hinaus wurden auch in Anrainerstaaten, in denen bisher keine Ausbrüche vorgekommen sind, verstärkt Ressourcen in LASV-Diagnostik investiert. In Deutschland besteht für LASV laut Infektionsschutzgesetz (IfSG) §7 eine Labormeldepflicht. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
Welche Bekämpfungsstrategien gibt es? |
|
Eines der wichtigsten Werkzeuge zur Kontrolle und Prävention von LASV ist die Aufklärung der Bevölkerung über das Virus, seinen natürlichen Wirt und wie es auf den Menschen übertragen wird. Da die Übertragung vom natürlichen Wirt auf den Menschen ausschlaggebend für das Entstehen von LASV-Ausbrüchen ist, ist einer der wichtigsten Ansatzpunkte die Kontaktreduzierung zwischen Menschen und Mastomys. Bereits simple Maßnahmen wie die Lagerung von Nahrungsmitteln in verschlossenen Behältern, oder das Aufstellen von Fallen in und um Behausungen können einen Effekt haben. Die Pestbekämpfung im größeren Maßstab stellt eine weitere Option dar, um die Nagetierpopulation zu reduzieren. Durch die weite Ausbreitung, hohe Anpassungsfähigkeit und Reproduktionsrate von Mastomys natalensis können hiermit jedoch meist keine anhaltenden Erfolge erzielt werden, sofern die Maßnahmen nicht kontinuierlich fortgesetzt werden. Darüber hinaus ist die frühzeitige Erkennung von LASF-Fällen essenziell, um Ausbrüchen zu verhindern bzw. einzudämmen. |
|
Wo liegen zukünftige Herausforderungen? |
|
Durch das weite Verbreitungsgebiet des natürlichen Wirtstieres sind große Bevölkerungsteile in Sub-Sahara Afrika einem potenziellen Risiko ausgesetzt. Durch die Existenz weitere Reservoir-Spezies wird dieses Risiko weiter erhöht. Aufgrund des epidemischen Potenzials wurde LASV im Jahr 2016 von der Weltgesundheitsorganisation (WHO) als Erreger, welcher eine Bedrohung mit pandemischem Potential darstellt, hervorgehoben. Im Rahmen des R&D Blueprint Plans rief die WHO dazu auf verstärkt an Vakzinen und möglichen Therapien zu forschen. LASV hat jedoch eine hohe genetische Diversität und verschiedene Stämme variieren stark in Bezug auf Pathologie, Virulenz und Krankheitsbild. Dies erschwert die Entwicklung einheitlicher diagnostischer Tests und Behandlungsmethoden und bildet eine der größten Herausforderungen in der LASF-Bekämpfung. Des Weiteren könnten politische, sozial-ökonomische, sowie ökologische Veränderungen in Ländern, in denen das Virus bereits endemisch ist, ungeahnte Folgen für die Ausbreitung des LASV und des Wirtstieres haben was eine Ausbreitung des Verbreitungsgebietes zur Folge haben könnte. |
Für die fachliche Unterstützung bei der Erstellung des Lassavirus-Steckbriefes danken wir Chris Hoffmann und Nele Burckhardt vom Bernhard-Nocht-Institut für Tropenmedizin, Hamburg, Deutschland.
Oktober 2021 - Mycobacterium tuberculosis

Abbildung: Mikroskopische Läsionen und Erregernachweise in der Lungentuberkulose eines Rindes (Details siehe PDF). Copyright: Dr. Jan Schinköthe, Institut für Veterinär-Pathologie, Fakultät für Veterinärmedizin, Universität Leipzig
|
Beschreibung |
|
Mycobacterium tuberculosis ist ein aerobes, langsam-wachsendes, gram-positives/labiles, unbewegliches, säurefestes, stäbchenförmiges Bakterium aus der Familie der Mycobacteriaceae. Eine Besonderheit im Vergleich zu anderen Bakterien ist die dicke, aus Wachsen, Mykolsäuren und Lipiden bestehende Zellwand, welche essentiell für die Persistenz der Bakterien innerhalb des Wirtes ist und maßgeblich die Immunreaktion des Wirtes beeinflusst. Die Infektion mit Mycobacterium tuberculosis, sowie anderen Mykobakterien aus dem Mycobacterium tuberculosis-Komplex (unter anderem: M. bovis, M. africanum, M. caprae u.a.) kann zum Krankheitsbild der sogenannten Tuberkulose (TB) führen. Die Tuberkulose ist eine der 10 häufigsten Todesursachen weltweit und die führende Todesursache durch einen einzelnen Infektionserreger mit ca. 2 Milliarden Infizierten sowie ca. 10 Millionen Neuinfektionen und 1,4 Millionen Todesfälle in 2019. M. bovis und M. caprae sind zoonotische Mykobakterien, die eng mit M. tuberculosis verwandt sind und zum sogenannten M. tuberculosis-Komplex gehören. M. bovis und M. caprae sind für die Tuberkulose bei Rindern bzw. kleinen Wiederkäuern verantwortlich, wobei sie im Allgemeinen ein breiteres Wirtsspektrum aufweisen als M. tuberculosis. Während das Wirtsspektrum von M. tuberculosis fast ausschließlich Menschen und nicht-menschliche Primaten sind, ist M. bovis Ursache für die meisten zoonotischen TB-Fälle. Alle Erreger des M. tuberculosis Komplex werden der Risikogruppe 3 nach Biostoff-Verordnung zugeordnet und experimentelle Arbeiten mit diesen Erregern ist speziellen Einrichtungen der Schutzstufe (biosafety level, BSL) 3 vorbehalten. |
|
Erstmals entdeckt |
|
Es wird angenommen, dass Tuberkulose seit mindestens 150 Millionen Jahren existiert und sich parallel mit dem Menschen als Primärwirt im Prozess der Koevolution entwickelt hat. Bis ins 19. Jahrhundert hinein waren Infektionskrankheiten wie Tuberkulose die Haupttodesursache weltweit, obwohl zum damaligen Zeitpunkt die Existenz von Bakterien nicht bekannt war. Erst 1865 konnte durch Jeon-Antoine Villemin gezeigt werden, dass Tuberkulose infektiös und ansteckend ist. Es dauerte fast weitere 20 Jahre, bis schließlich der Arzt Robert Koch den Erreger der Tuberkulose M. tuberculosis 1882 durch eine neue Färbemethode identifizieren konnte. Robert Koch ist es daraufhin auch gelungen, den Zusammenhang zwischen Krankheitserreger und Krankheit nachzuweisen und so den Weg für Therapien und Präventionsmaßnahmen zu ebnen. Dafür wurde er 1905 mit dem Nobel Preis der Medizin ausgezeichnet und gilt als der Wegbereiter der Mikrobiologie. |
|
Wo kommt der Erreger vor? |
|
Infektionen mit Bakterien des Mycobacterium tuberculosis-Komplexes kommen weltweit vor und etwa ein Viertel der Weltbevölkerung ist infiziert. Je nach Region variieren die Inzidenzen sehr stark. Besonders betroffen sind einkommensschwache Länder. Während in Südostasien 44 %, in Afrika 25 % und im westlichen Pazifik 18 % der weltweiten TB-Fälle auftreten, sind es nur 2,9 % in Nordamerika und 2,5 % in Europa. Zu Beginn des 20. Jahrhunderts waren auch Europa und Nordamerika noch wesentlich stärker von TB betroffen. Hier zeigten verbesserte Hygiene, die sozioökonomische Entwicklung, sowie strikte Eradikationsprogramme Erfolg, und Krankheits-, sowie Todesfälle gingen deutlich zurück. Weltweit sind die Bemühungen im Kampf gegen TB groß. Dennoch liegt die jährliche Abnahme der Inzidenz aktuell bei nur 2,9 %. Für das Ziel der WHO, die Epidemie bis 2030 zu beenden, ist dieser Rückgang jedoch viel zu gering. |
|
Betroffene Tierspezies, Reservoir |
|
Das prominenteste Mitglied des M. tuberculosis-Komplexes M. tuberculosis hat sich über die Jahrtausende hervorragend an den Menschen angepasst, sodass dieser sein einziges Erregerreservoir darstellt. Bei sehr engem Kontakt zwischen Mensch und Tier, wie beispielsweise bei Haustieren, kann es allerdings zu einer Krankheitsübertragung kommen. Die anderen genetisch eng verwandten Mitglieder des M. tuberculosis-Komplexes sind weit verbreitet in der Tierwelt. So sind vom Erreger der Rindertuberkulose M. bovis Rinder, Ziegen und zahlreiche andere Wildtiere wie Rothirsche, Wildschweine und Dachse betroffen. Weitere Tierspezies, die durch zoonotische Mitglieder des M. tuberculosis-Komplexes betroffen sind, sind Nagetiere (M. microti) und Seehunde (M. pinnipedii). Auch wenn die zoonotischen Tuberkulose-Erreger ein von M. tuberculosis nicht zu unterscheidendes Krankheitsbild im Menschen auslösen, gehört der Mensch nicht wirklich zum Erregerreservoir, da die Erreger von infizierten Menschen nur schlecht weitergegeben werden. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
M. tuberculosis wird in den allermeisten Fällen durch Tröpfcheninfektion von Mensch zu Mensch übertragen. Patienten mit einer offenen Lungentuberkulose scheiden dabei Bakterien z.B. durch Husten aus, welche dann über Aerosole von anderen eingeatmet werden können und in die Lunge gelangen. Eine Infektion mit M. bovis kann durch den Konsum von nicht-pasteurisierter Milch infizierter Tiere (Kühe, Ziegen, Kamele) stattfinden. Gravierende Unterschiede der TB-Inzidenzen zwischen einkommensschwachen und -starken Ländern lassen sich auf soziale und ökonomische Faktoren zurückführen. Armut, fehlender Zugang zu Hygiene und vollwertiger Nahrung, Luftverschmutzung, Überbevölkerung, mangelnde soziale Absicherung und medizinische Versorgung führen zu hohen Fallzahlen. Die inadäquate Versorgungssituation ist auch im Hinblick auf die Entwicklung von Antibiotika-Resistenzen besonders problematisch. Die fünf wichtigsten Risikofaktoren nach einer Infektion mit Mykobakterien auch an Tuberkulose zu erkranken, sind eine HIV-Infektion, Mangelernährung, Diabetes Typ 2, Rauchen und Alkohol-Missbrauch. Diese Risikogruppen haben auch eine höhere Wahrscheinlichkeit schwerer zu erkranken und an der Infektion zu sterben. Dass deutlich mehr TB-Fälle bei Männern als bei Frauen auftreten, lässt sich auch dadurch erklären, dass diese zu höheren Anteilen den Risikogruppen angehören. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Nach Infektion zeigt der Wirt zunächst keine Symptome, das Bakterium wird in sogenannten Granulomen von Immunzellen im mittleren Teil der Lunge eingeschlossen. Diese werden auch als geschwülstartige Veränderungen/Knoten oder Tuberkel bezeichnet. Dort ruht die Infektion meist über einige Jahre bis Jahrzehnte symptomlos, die Bakterien sind inaktiv und verfallen in einen „Winterschlaf“. Die Bakterienzahl bleibt gering, die Verteilung im Körper wird verhindert und der Wirt bleibt gesund, jedoch schafft es das Immunsystem auch nicht, die Infektion zu beseitigen. Diese Phase wird auch als latente (geschlossene) Tuberkulose bezeichnet und man geht davon aus, dass bis zu ein Viertel der Weltbevölkerung auf diese Weise mit Tuberkulose infiziert ist. In Folge einer Schwächung des Immunsystems oder einer Reinfektion entwickelt sich in 5 – 10 % aller Fälle daraus jedoch eine aktive (offene) Tuberkulose. Das Granulom „verkäst“, wird nekrotisch. Die zuvor noch inaktiven Bakterien werden aktiv und breiten sich aus. Es zeigen sich jetzt die typischen Symptome wie Husten, Brustschmerzen, Müdigkeit, Erschöpfung, Gewichtsverlust, Fieber und Nachtschweiß. Auch andere Organe können von der Tuberkulose betroffen sein (extrapulmonäre Tuberkulose/Miliartuberkulose), sollten die Bakterien in die Blutbahn gelangen. Bei der extrapulmonalen Tuberkulose haben Gebärmutter-, Darm- und Hodentuberkulose die größte Bedeutung. Ohne Behandlung beträgt die Letalität 0,7 (d.h. 70 von 100 Patienten versterben). |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Die Behandlung der Tuberkulose ist möglich, aber langwierig und kompliziert. Sie wird mit Antibiotika durchgeführt. Je nachdem, ob es sich um die latente, subklinische oder akute Form der TB handelt, werden gleiche Wirkstoffe, aber andere Behandlungsschemata eingesetzt. Auch Kontaktpersonen von Erkrankten sowie Risikogruppen können präventiv behandelt werden. Die Behandlung einer aktiven Tuberkulose besteht bevorzugt aus einer vierfach Antibiose aus Isoniazid, Rifampicin, Pyrazinamid und Ethambutol über zwei Monate, gefolgt von einer kombinierten Gabe von Isoniazid und Rifampicin über vier Monate. Diese Behandlung ist ziemlich erfolgreich (85 %), geht aber vor allem durch die lange Dauer der Gabe auch mit einigen Nebenwirkungen einher. Die Dauer der Gabe erschwert zusätzlich die Compliance der Patienten aber nur eine lange Einnahme der Antibiotika kann zur Heilung führen. Etwa 20 % der TB-Fälle sind Rifampicin- oder „multidrug“-resistent, was eine erfolgreiche Behandlung deutlich komplizierter oder gar unmöglich macht. Hier wird eine verlängerte Behandlung (6-20 Monate) mit zusätzlichen Antibiotika wie Flourchinolonen oder neuen Wirkstoffen versucht, die Nebenwirkungen sind schlimmer und die Erfolgsrate liegt bei nur 57 %. Es gibt nur einen zugelassenen Impfstoff gegen Tuberkulose. Bacille-Calmette-Guérin (BCG) ist ein lebend-attenuierter Mycobakterium bovis-Stamm, der im frühen 20. Jahrhundert entwickelt wurde. Er wurde 1921 das erste Mal verimpft und ist nach wie vor einer der weltweit am häufigsten genutzten Impfstoffe. Er schützt vor hochgradiger Kindheits-TB, bietet aber wenig Schutz vor Lungentuberkulose bei Erwachsenen. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Aufgrund des fehlenden präventiven Schutzes in Form eines wirkungsvollen Impfstoffes, ist das Überwachungssystem essentiell zur Eindämmung von Tuberkulose. So sind leistungsfähige Gesundheitsämter von zentraler Bedeutung um Übertragungswege aufzuklären und Ausbruchsgeschehen frühzeitig zu erkennen und zu stoppen. Bisher ist das noch nicht in dem Maße gewährleistet, um auch das ambitionierte Ziel der WHO, die TB Pandemie einzudämmen, zu erreichen. So sind selbst in Industrieländern wie Deutschland die Neuerkrankungen nicht rückläufig. Somit sind laut dem Robert Koch-Institut (RKI) bei der Tuberkulose-Kontrolle auch in Deutschland zusätzliche Anstrengungen notwendig. Sehr viel dramatischer ist die Lage allerdings in sozioökonomisch schwachen Regionen. So zeigen Studien beispielsweise in ländlichen Regionen Südafrikas hohe Raten von nicht diagnostizierter aktiver Tuberkulose. Eine wichtige Aufgabe bleibt somit weiterhin, das Gesundheitswesen gerade in Entwicklungsländern zu stärken. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Obwohl die aktuellen Präventions- und Behandlungsstrategien jährlich zahlreiche Todesfälle durch Tuberkulose verhindern, wird eine erfolgreiche Eindämmung der Tuberkulose nur mit neuen und effektiveren Medikamenten und Impfstoffen möglich sein. Aus diesem Grund sind dies zwei wichtige Forschungsschwerpunkte. Aktuell werden über 14 Impfstoffkandidaten (Stand August 2020) in Phase eins bis drei Versuchen getestet. Verschiedene Mechanismen (lebend-attenuiert, viraler Vektor, Protein/Adjuvant), sowie unterschiedliche Antigene werden hierbei eingesetzt und untersucht. Das Ziel muss es sein, Impfstoffe zu entwickeln, die einen besseren Schutz bieten als BCG und bei Kindern und Erwachsenen eingesetzt werden können. Auch wäre die Möglichkeit zum therapeutischen Einsatz wünschenswert. Die Grundlage für eine erfolgreiche Impfstoffentwicklung liegt auch im umfangreichen Wissen über Pathogenese und Immunologie einer Mykobakterien-Infektion. Da es in diesem Bereich noch einige Lücken gibt, liegt hier ein weiterer Forschungsschwerpunkt. Bei der Erforschung neuer Medikamente liegt der Schwerpunkt vor allem darauf, kürzere und einfachere Behandlungsstrategien zu entwickeln. Außerdem wird stetig versucht, Wirkstoffe zu entwickeln und zu entdecken, die gegen (multi-)resistente TB einsetzbar sind. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Das Ziel der „WHO End TB Strategie“ ist, die globale TB Epidemie zu beenden, dafür soll bis 2030 die Rate der Neuinfektionen um 80 % und die der Todesfälle um 90 % im Vergleich zu 2015 reduziert werden. Zur Erfüllung dieser Ziele ist es wichtig, dass die Strategie an die Bedingungen und Voraussetzungen an jedes Land einzeln angepasst wird. Im Grunde beruht die Strategie aber auf 3 Eckpfeilern. Der erste Eckpfeiler ist eine ganzheitliche Tuberkulose Pflege und Prävention, welche sich an den Bedürfnissen des Patienten orientiert. Dafür ist insbesondere die frühe Diagnose von TB und der einfache Zugang zur medizinischen Versorgung elementar. Der zweite Eckpfeiler benötigt die intensive Beteiligung von Politik und privater Interessenvertreter. So ist eine beherzte Politik mit unterstützenden Maßnahmen unabdingbar, um den sozialen Gesundheitssektor zu stärken und die TB Epidemie zu beenden. Nicht zuletzt ist es wichtig, Forschung und Innovationen zu fördern, worauf der dritte Eckpfeiler beruht. Die TB Epidemie kann nur beendet werden, wenn neue Impfstoffe und Medikamente zur Verfügung stehen. |
|
Wo liegen zukünftige Herausforderungen? |
|
Da die erfolgreiche Bekämpfung der Tuberkulose sehr viel mit sozialen und ökonomischen Faktoren einer Region zusammenhängt, liegt hier eine aktuelle und zukünftige Herausforderung. Diagnostik und Behandlung muss auch die Menschen in ärmeren Regionen gut erreichen. Vor allem einkommensstarke Nationen müssen weiter dafür sensibilisiert werden, dass Tuberkulose nach wie vor weltweit eine große Rolle spielt, so dass Hilfe vor Ort und Forschung auch in Zukunft finanziert werden können. Durch die COVID-19 Pandemie hat sich die allgemeine Situation in von TB stark betroffenen Ländern im letzten Jahr deutlich verschlechtert. Bis zu 50 % weniger TB-Erkrankungen konnten diagnostiziert und behandelt werden. Es ist eine große Herausforderung diese Rückschritte möglichst schnell abzufangen und umzukehren. Durch Migration aus von Tuberkulose stark betroffenen Ländern in niedrig Inzidenzgebiete, wie Europa und Nordamerika, kann es auch dort zu einem Anstieg an positiven Fällen kommen. Die Inzidenz wird hier aber wohl durch gute sozioökonomische und medizinische Versorgung weiter auf einem niedrigen Level bleiben. Wenn durch den Klimawandel oder anders bedingte Naturkatastrophen das Nahrungsangebot in von Hunger betroffenen Ländern weiter verknappt wird und somit noch mehr Menschen von Mangelernährung betroffen sein werden, wird das den Kampf gegen TB erschweren, da die Unterversorgung schon heute der zahlenmäßig größte Risikofaktor für TB ist. Die erfolgreiche TB Bekämpfung wird sich also auch in Zukunft nur durch eine umfassende Strategie voranbringen lassen. |
|
Sonstiges |
|
WHO: https://www.who.int/teams/global-tuberculosis-programme/TB-reports/global-tuberculosis-report-2020 RKI: https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Tuberkulose.html |
Für die Erstellung des Steckbriefes zu Mycobacterium tuberculosis danken wir Emmelie Eckhardt und Fabian Stei vom Friedrich-Loeffler-Institut, Insel Riems.
September 2021 - Vibrionen
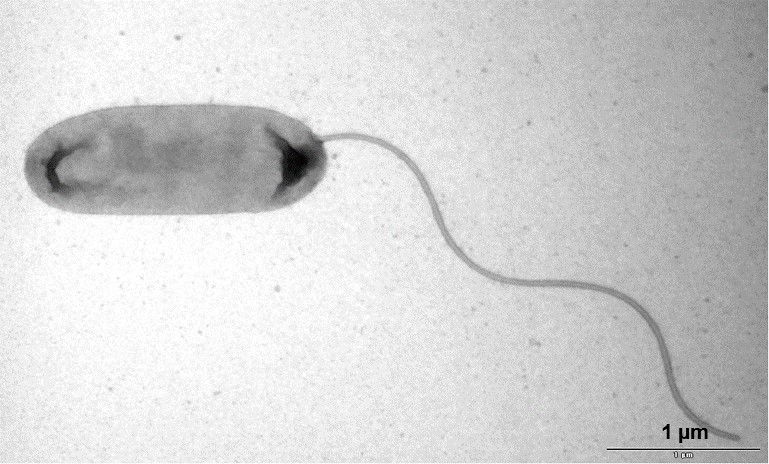
Abbildung: Transmissionselektronenmikroskopische Aufnahme eines Vibrio-Bakteriums (Aufnahme: Jochen Reetz, BfR)
|
Beschreibung |
|
Vibrionen sind gram-negative Stäbchenbakterien, für die eine kommaartige Form charakteristisch ist. Durch das Vorhandensein einer polaren Begeißelung sind diese Bakterien sehr beweglich und können Geschwindigkeiten von bis zu 147 µm/s in flüssigem Milieu erreichen. Die Zellen weisen eine Breite von 0,5 bis 0,8 µm und eine Länge von 1,4 bis 2,6 µm auf. Vibrionen besitzen die Fähigkeit, unter aeroben oder fakultativ anaeroben Bedingungen zu wachsen, wobei sie hohe Salzkonzentrationen und pH-Werte tolerieren können. Derzeit sind über 130 verschiedene Spezies der Gattung Vibrio (V.) bekannt (https://lpsn.dsmz.de/genus/vibrio), wovon 12 als potentiell humanpathogen eingestuft werden. Die größte Rolle unter den humanpathogenen Vertretern spielen hierbei V. cholerae, V. parahaemolyticus und V. vulnificus. Neben der Cholera, welche durch die V. cholerae Serotypen O1 und O139 ausgelöst wird, verursachen non-O1/non-O139 V. cholerae und V. parahaemolyticus ebenfalls nach oraler Aufnahme intestinale Erkrankungen. Extraintestinale Infektionen (z.B. Wund- und Ohrinfektionen) über direkten Haut- und Wundkontakt werden meist mit V. vulnificus, aber auch mit non-O1/non-O139 V. cholerae in Verbindung gebracht. |
|
Erstmals entdeckt |
|
Vibrionen wurden erstmalig durch Filippo Pacini 1854 als Ursache der Cholera beschrieben. Erst 1884 konnte Robert Koch diese Hypothese bestätigen, indem er die Bakterien in direkten Zusammenhang mit der Erkrankung brachte. Es gelang ihm, das Bakterium aus Stuhlproben von Cholerapatienten in Indien und Ägypten zu isolieren und erneut zu kultivieren. Er beschrieb das Bakterium als kommaförmiges, hoch bewegliches Stäbchen, wodurch er die Bezeichnung Vibrio comma prägte. Der Name Vibrio leitete sich hierbei vom griechischen „vibrare“ aufgrund ihrer hohen Beweglichkeit unter dem Mikroskop ab. Seit 1817 von Indien ausgehend wird der Serotyp V. cholerae O1 Biotyp classical und Biotyp El Tor für insgesamt sieben Cholera-Pandemien verantwortlich gemacht. Seit 1961 kommt es regelmäßig zu Cholera-Epidemien ausgehend von Indonesien, die auf den Biotyp El Tor zurückzuführen sind und die zur siebten, bis heute anhaltenden, Pandemie gezählt werden. Seit 1992 wurde in Epidemien zusätzlich eine neue Variante des Biotyps El Tor (atypical) sowie der Serotyp O139 detektiert. Im Jahr 2021 fanden sich Cholera-Ausbrüche in Bangladesch, Jemen und Teilen Afrikas. Weltweit wird geschätzt, dass 1,3 bis 4,0 Millionen Fälle und 21 000 bis 143 000 Todesfälle pro Jahr durch die V. cholerae Serotypen O1 und O139 verursacht werden. V. parahaemolyticus wurde erstmalig 1951 von Fujio Tsunesaburō als Ursache einer Durchfallerkrankung nach einem Ausbruch einer lebensmittelassoziierten Infektion in Japan nach dem Verzehr eines halbtrockenen Fischproduktes „Shirasu“ beschrieben. Seitdem wurden weltweit lokale Infektionsgeschehen bis hin zu Epidemien in Zusammenhang mit dem Verzehr von Fisch und Meeresfrüchten gemeldet. Die letzte Epidemie fand in Chile 2004 durch den Serotyp O3:K6 statt. Dieser Serotyp wurde ebenfalls im selben Zeitraum in Ausbrüchen in Frankreich, Spanien und Mosambik detektiert. Der letzte große Ausbruch wurde 2019 in Kalifornien durch den Verzehr von importierten Austern aus Mexiko verzeichnet. V. vulnificus wurde erstmals 1976 aus Blutproben von Patienten mit einer Sepsis isoliert und als Verursacher dieser als Laktose-positive Vibrio sp. beschrieben. Seitdem werden weltweit Infektionen im Zusammenhang mit einem direkten Kontakt über Wunden oder Hautläsionen beim Baden in Gewässern verzeichnet. In den Jahren 2018 und 2019, welche durch (früh)-sommerliche Hitzewellen geprägt waren, wurden 25 Infektionen im Zusammenhang mit Badeaktivitäten an der deutschen Ostseeküste festgestellt, die letztlich mit fünf Todesfällen verbunden waren. Im Jahr 2020 wurden lediglich fünf V. vulnificus-Infektionen gemeldet, wobei dieser Rückgang auf die eingeschränkten Reisemöglichkeiten durch die COVID-19 Pandemie zurückgeführt wird. |
|
Wo kommt der Erreger vor? |
|
Bakterien der Gattung Vibrio kommen in aquatischen Ökosystemen von Süßwasser über Brackwasser bis hin zum offenen Meer vor und sind weltweit verbreitet. Aus diesem Grund sind Vibrionen auch mit Lebensmitteln wie Fischen und Meeresfrüchten assoziiert. Da das Wachstum von Vibrionen stark von der Wassertemperatur abhängt, können diese in gemäßigten Klimazonen vor allem saisonal in den Sommermonaten in aquatischen Habitaten kulturell nachgewiesen werden. Bereits ab einer Wassertemperatur von 10°C steigen die Konzentrationen von Vibrio spp. an. Das Überleben in den Wintermonaten wird u. A. durch die Ausbildung einer Überdauerungsform, dem VBNC-Stadium (viable but non-culturable - lebend aber nicht kultivierbar) gesichert. In diesem Stadium können Vibrionen mittels klassischer kultureller mikrobiologischer Diagnostik nicht nachgewiesen werden. In tropischen Gewässern kommen Vibrionen hingegen ohne saisonale Schwankungen vor. |
|
Betroffene Tierspezies, Reservoir |
|
Zooplankton, speziell Copepoden (Ruderfußkrebse), stellen ein natürliches Reservoir für Vibrionen dar. Vibrionen haben die Fähigkeit, sich auf dem chitinhaltigen Exoskelett über Chitin-spaltende Enzyme anzuheften bzw. einzubetten, um diesen zu kolonisieren und gleichzeitig als Nährstoffquelle zu nutzen. Eine einzelne Copepode kann eine konstante Besiedelung von 104 bis 106 Vibrionen aufweisen. Innerhalb von Plankton können Vibrio-Konzentrationen von bis zu 109 KbE/ml erreicht werden. Neben der Besiedlung von Zooplankton kommen Vibrionen auf der Haut bzw. Oberfläche, aber auch als Kommensale im Verdauungstrakt von marinen Lebewesen wie Fischen, Krustentieren, Muscheln und Quallen vor. Im Verdauungstrakt von Penaeus vannamei (Weißbeingarnele) konnten beispielsweise Vibrio-Konzentrationen von 104 bis 105 KbE/g nachgewiesen werden. Aber auch im Verdauungstrakt von Seevögeln oder marinen Säugetieren (z.B. Robben) können Vibrionen z.T. in hohen Konzentrationen nachgewiesen werden. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Lebensmittelinfektionen stehen im Zusammenhang mit kontaminiertem Fisch und Fischprodukten sowie Meeresfrüchten, welche im rohen Zustand (v. a. Austern und Sushi) oder nicht ausreichend erhitzt verzehrt wurden. Aber auch kontaminiertes Wasser, welches als Trinkwasser oder zum Zubereiten von Speisen unter unzureichender Erhitzung verwendet wurde, kann zu einer Lebensmittelinfektion führen. Im Fokus von lebensmittelassoziierten Infektionen stehen vor allem V. cholerae und V. parahaemolyticus. Infektionen über kontaminiertes Trink- oder Brauchwasser sind vor allem V. cholerae zuzuordnen. Infektionsdosen mit V. cholerae kontaminiertem Wasser liegen bei 108 bis 1011 KbE/ml. Die infektiöse Dosis durch den Verzehr kontaminierter Lebensmittel mit V. parahaemolyticus liegt bei ca. 105 bis 107 KbE/g und mit V. cholerae bei ca. 104 bis 108 KbE/g. Die hohen Infektionsdosen sind aufgrund der Säureempfindlichkeit von Vibrio spp. im Magen zurückzuführen. Die Einnahme von Medikamenten, die zur Hemmung der Magensäure dienen, können daher die Infektionsdosen herabsetzen. Eine Infektion mit V. vulnificus erfolgt primär über einen direkten Kontakt der Bakterien mit Wunden oder Hauläsionen z.B. beim Baden in Gewässern mit moderaten Temperaturen und Salzgehalten, (US Atlantik, Golf von Mexiko, Ostsee etc.). Darüber hinaus wurden aber auch schwere humane Infektionen, z.T. mit Todesfolge, durch den Verzehr von kontaminierten Meeresfrüchten berichtet. Zu den Risikogruppen zählen vor allem Kinder, Schwangere, ältere Menschen und immunsupprimierte Personen mit chronischen Erkrankungen oder Menschen, die immunsupprimierende Medikamente einnehmen. Bereits eine geringe Bakterienzahl kann für eine Wundinfektion bei prädisponierten Personen ausreichend sein. Extraintestinale Infektionen über einen direkten Wund-, Ohr- oder Augenkontakt können aber auch durch non-O1/non-O139 V. cholerae verursacht werden. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Je nach Vibrio-Spezies und Infektionsart treten unterschiedliche Krankheitssymptome auf. Symptome einer oral erworbenen Infektion mit dem humanmedizinisch bedeutendsten Vertreter V. cholerae O1/O139 sind „reiswasserartige“ Gastroenteritis/Diarrhö (Cholera-Symptome). Der „reiswasserartige“ Durchfall kann in 25% der Fälle blutig sein und geht mit Bauchkrämpfen, Übelkeit, Erbrechen und Fieber einher. Während der Kolonisierung des Dünndarmepithels werden Virulenzfaktoren wie das Choleratoxin exprimiert, welches für die charakteristisch sekretorische Diarrhö maßgeblich mit verantwortlich ist. Durch das Auslösen eines osmotischen Ungleichgewichts wird ein extrem gesteigerter Ausstrom von Wasser aus den Zellen in das Darmlumen verursacht. Massive Wasser- und Mineralstoffverluste sind die Folge und können ohne Medikation zum Tod führen. Die Inkubationszeiten können zwischen 6 Stunden und 3 Tagen variieren. Cholera-ähnliche Symptome können jedoch auch durch die orale Aufnahme von non-O1/non-O139 V. cholerae verursacht werden. Obwohl diese Stämme genetisch nicht in der Lage sind, die typischen Cholera verursachenden Virulenzfaktoren wie das Choleratoxin zu exprimieren, weisen sie dennoch andere Virulenzfaktoren auf, die es ihnen ermöglichen, auch schwere Gastroenteritiden auszulösen. Non-O1/non-O139 V. cholerae können über einen direkten Kontakt mit Augen, Ohren oder Wunden auch zu extraintestinalen Infektionen sowie Septikämien führen. Lebensmittelinfektionen mit V. parahaemolyticus resultieren überwiegend in Durchfallerkrankungen, einhergehend mit Bauchkrämpfen, Übelkeit, Erbrechen, Kopfschmerzen und Fieber. Die Symptome treten gewöhnlich zwischen 4 bis 24 Stunden nach oraler Aufnahme auf und sind in der Regel selbstlimitierend. Die Pathogenität korreliert bei diesen Stämmen mit dem Vorhandensein von bakteriellen Sekretionssystemen in Kombination mit hitzestabilen Hämolysinen (TDH und TRH) welche humane Erythrozyten lysieren können. Dieses Zusammenspiel der Virulenzfaktoren kann ebenfalls ein Eindringen der Bakterien in die Blutbahn ermöglichen und zu systemischen Erkrankungen wie Septikämien führen. V. vulnificus ist ein komplexes Bakterium, dessen Pathogenität auf einem multifaktoriellen System (Säureneutralisation, Kapselproduktion, Eisenaufnahme, Zytotoxizität, Beweglichkeit und Proteine für Anheftung) beruht. Wundinfektionen mit V. vulnificus können zu tiefgreifenden Nekrosen bis hin zur Amputation der betroffenen Gliedmaßen führen. Daraus resultierende schwere septische Verläufe können aufgrund multiplen Organversagens bis hin zum Tod führen. Dabei weist V. vulnificus mit >50% eine sehr hohe Letalitätsrate auf. Die Inkubationszeit nach einer Infektion beträgt zwischen 12 Stunden und 3 Tagen. Lebensmittelinfektionen durch V. vulnificus mit systemischen Verläufen sind selten, können jedoch bei immunsupprimierten Personen vorkommen und zu schweren Verläufen mit Todesfolge führen |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Gegen V. cholerae O1/O139-Infektionen, gibt es einen Schluckimpfstoff, der für Erwachsene und Kinder ab 2 Jahren bei Reisen in endemische/epidemische Gebiete empfohlen wird. Dieser Impfstoff bietet einen Infektionsschutz von ca. 85% und ist altersabhängig zwischen 6 Monaten und 2 Jahren lang protektiv. Es handelt sich um einen Impfstoff mit inaktiviertem Material verschiedener V. cholerae Stämme des Serotyps O1 sowie eine rekombinant erzeugte nicht toxische B-Untereinheit des Cholera-Toxins. Die Wirkung des Impfstoffs basiert auf induzierten Antikörpern gegen die bakteriellen Komponenten sowie das Cholera-Toxins. Die Antikörper verhindern eine Anheftung der Bakterien an die Darmwand und somit eine Besiedelung des Darms durch den Erreger. Die Antitoxin-Antikörper verhindern, dass sich das Cholera-Toxin an die Schleimhautoberfläche des Darms bindet und die durch das Toxin hervorgerufenen Durchfallsymptome ausbleiben. Augen-, Ohr- und Wundinfektionen, die in Kombination mit einer Exposition in marinen Gewässern und Brackwasser auftreten, sollten unverzüglich auf Verdacht einer Infektion mit Vibrionen behandelt werden. Solche Infektionen werden vorwiegen von Nicht-Cholera-Vibrionen, wie V. vulnificus und non-O1/non-O139 V. cholerae verursacht. Bei einem klinischen Verdacht wird eine sofortige antibiotische Therapie noch vor der mikrobiologischen Diagnostik empfohlen. Eine effektive Behandlungsmethode stellt die kombinierte Therapie mit Antibiotika der Klasse Cephalosporine (3. Generation) und Tetrazyklinen sowie eine zusätzliche Anwendung von Gyrasehemmern dar. Neben der Antibiose wird ebenfalls zu einem frühzeitigen chirurgischen Entfernen des betroffenen Gewebes geraten. Unverzügliche antibiotische Therapien werden ebenfalls bei Cholera-Symptomen und Verdacht einer Infektion mit V. cholerae O1/O139 sowie bei schweren Gastroenteritiden und Verdacht einer Infektion mit non-O1/non-O139 V. cholerae und V. vulnifivus angewandt, besonders wenn durch Vorerkrankungen wie Diabetes oder Leberzirrhosen ein erhöhtes Sepsis-Risiko besteht. Bei klinischen Verdachtsfällen, die im Zusammenhang mit dem Konsum von kontaminierten Fisch- und Meeresfrüchten sowie Trinkwasser stehen, wird eine kombinierte Therapie mit Antibiotika der Klasse Cephalosporine (3. und 4. Generation), Chinolone und Tetrazykline sowie eine zusätzliche Anwendung von Gyrasehemmern empfohlen. Zusätzlich sollten stabilisierende Maßnahmen zum Ausgleich der durch den Durchfall bedingten Flüssigkeits- und Salzverluste durchgeführt werden. Da Durchfallerkrankungen mit V. parahaemolyticus oder dessen hitzestabilen Toxinen (TDH und TRH) in der Regel nach wenigen Stunden selbstlimitierend sind, gibt es hierfür keine empfohlene Medikamentation. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
In Deutschland besteht neben der Meldepflicht für Infektionen mit V. cholerae O1/O139 seit dem Jahr 2020 auch eine Meldepflicht für Infektionen mit Nicht-Cholera-Vibrionen gemäß dem Infektionsschutzgesetz (IfSG). Eine Diagnose muss daher an das jeweilige Gesundheitsamt und weiter über die Landesbehörde an das RKI gemeldet werden. In der EU-Richtlinie 2006/7/EG zur Überwachung der Qualität von Badegewässern ist die mikrobiologische Überwachung von Vibrionen jedoch nicht geregelt. Hier sind ausschließlich Bewertungskriterien auf Grundlage der Gehalte an intestinale Enterokokken und Escherichia (E.) coli im Gewässer festgelegt. Das European Center for Disease Prevention and Control (ECDC) meldet seit 2013 jährlich für die Sommerperiode ein hohes bis sehr hohes Infektionsrisiko mit Vibrio spp. für die europäische Ostseeküste. Auch auf den Webseiten der Landesgesundheitsämter (Mecklenburg-Vorpommern, Niedersachen und Schleswig-Holstein) wird auf mögliche Infektionsrisiken hingewiesen. Das EU-Lebensmittelrecht beinhaltet keine spezifischen mikrobiologischen Kriterien in Bezug auf Vibrio spp. in Lebensmitteln. Das Scientific Commitee on Veterinary Measures relating to Public Health (SCVPH, 2001) bewertet die derzeitig vorliegenden wissenschaftlichen Daten als nicht ausreichend zur Festlegung von mikrobiologischen Kriterien für potentiell humanpathogene Nicht-Cholera-Vibrionen, wie non-O1/non-O139 V. cholerae, V. parahaemolyticus und V. vulnificus, in Fischerzeugnissen und Meeresfrüchten. Es wird daher empfohlen, Leitlinien zur guten Hygienepraxis zu erarbeiten. In Verordnungen zur Einhaltung der Hygiene für lebende Muscheln (VO (EG) 853/2004 und VO (EG) 854/2004) und Weichtiere (VO (EG) 2073/2005) sind ausschließlich Salmonella-, E. coli- und koagulase-positive Staphylokokken-Gehalte als mikrobiologische Kriterien festgehalten. Dennoch existieren seit 2021 Empfehlungen zur Beurteilung von Vibrio spp. in Lebensmitteln durch den Arbeitskreis der auf dem Gebiet der Lebensmittelhygiene und der Lebensmittel tierischer Herkunft tätigen Sachverständigen (ALTS), der Bezug auf Artikel 14 Abs. 4 und 5 der VO (EG) 178/2002 nimmt (inkl. Kriterien der SCVPH, EFSA und WHO/FAO). |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Vibrio-Infektionen gewinnen auch in Deutschland aufgrund der globalen Klimaerwärmung und der Zunahme des weltweiten Handels mit Fischereiprodukten und Meeresfrüchten zunehmend an Bedeutung. Aktuelle Forschungsfragen befassen sich vor allem mit Infektionsrisiken beim Baden in marinen Gewässern und durch den Verzehr von kontaminierten Lebensmitteln, insbesondere mit Produkten, die im rohen Zustand verzehrt werden (v.a. Austern und Sushi). Neben mikrobiologischen Nachweiskriterien und einer molekularbiologischen Spezies-spezifischen Detektion steht vor allem der Nachweis von Virulenzfaktoren und -mechanismen im Fokus, um das humanpathogene Potential der entsprechenden Vibrio-Isolate besser charakterisieren zu können. Insbesondere bioinformatische Analysen Gesamtgenom-sequenzierter Stämme spielen hierbei eine große Rolle. Für die Diagnostik ist eine Implementierung moderner Hochdurchsatzverfahren mit einer hohen Auflösung ratsam. Die Nutzung Gesamtgenom-basierter Typisierungsdaten ermöglicht eine bessere Überwachung und Bewertung einzelner Isolate, trägt aber auch zu einem besseren Verständnis der genetischen Variabilität der Erreger bzw. mechanistischer Systeme für deren Adaptation an die vorliegenden Umweltbedingungen bei. Für die Nutzung solcher Daten sind jedoch umfangreiche bioinformatische Neuentwicklungen zur Interpretation nötig, die spezifisch auf Vibrionen (z.B. Whole/Core Genome Multilocus Sequence Typing) und deren Charakteristika (Virulenz-assoziierte Gene, Pathogenitätsinseln etc.) ausgerichtet sind. Von großer Wichtigkeit ist ebenfalls die Bewertung von non-O1/non-O139 V. cholerae-, V. parahaemolyticus- und V. vulnificus-Spezies hinsichtlich ihrer natürlichen Reservoire insbesondere im Hinblick auf ihre Bedeutung im human- und tiermedizinischen Bereich. Hierbei stehen Untersuchungen potentieller Transmissionswege von Vibrio-Bakterien aus endemischen Gebieten (insb. Südost – und Ostasien, Mittel- und Südamerika) im Fokus. Vorangegangene Untersuchungen zeigen, dass insbesondere durch den globalen Warentransport, z.B. importierte Güter (Lebensmittel wie Fisch und Meeresfrüchte) aber auch durch Ballastwasser von Transportschiffen, klinisch relevante Isolate (z.B. mit komplexen und z.T. übertragbaren antimikrobiellen Resistenzen gegen Beta-Laktame/Carbapeneme sowie Virulenzfaktoren) nach Europa bzw. in europäische Gewässer eingebracht werden. Inwieweit sich entsprechende Isolate unter den gegebenen Umweltbedingungen in Deutschland oder anderen Teilen Europas etablieren können und die mikrobiellen Gemeinschaften nachhaltig beeinflussen oder zur Entstehung neuer Pathovare führen, muss noch genau studiert werden. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Menschen mit offenen Wunden oder frisch gestochenen Tattoos und/oder Vorerkrankungen sowie einem geschwächten Immunsystem sollten das Baden ab 20°C Wassertemperatur in relevanten Gewässern meiden. Neben dem Baden birgt auch das Spazieren bzw. Waten im küstennahen Meerwasser ein Risiko, da Vibrionen (insb. V. vulnificus) über kleinste Hautverletzungen aufgenommen werden können. Zur Minimierung von Vibrio-Infektionen (speziell V. parahaemolyticus) über Lebensmittel wie Fisch und Fischprodukte sowie Meeresfrüchte muss eine gute Herstellungspraxis über die gesamte Lebensmittelkette eingehalten werden. Besondere Herausforderungen treten bei künstlichen Produktionsstätten von Fisch bzw. Meeresfrüchten (Aqua- oder Marikulturen) auf. Hier gilt es, die Erreger möglichst aus den Produktionsstätten fernzuhalten bzw. zu minimieren. Dies kann z.B. über den gezielten Einsatz von neuartigen Wasserreinigungsstrategien sowie intensiven Kontrolluntersuchungen erfolgen. Innerhalb der Lebensmittelkette ist vor allem die Einhaltung der Kühlkette und die Vermeidung von Re- bzw. Kreuzkontaminationen von besonderer Bedeutung. Dies gilt auch für den Verbraucher, wo die Einhaltung der Kühlkette sowie der Küchenhygiene beim Zubereiten der Lebensmittel dringend empfohlen wird. Vor dem Verzehr sollten Meeresfrüchte gründlich unter Leitungswasser gewaschen werden und innerhalb weniger Tage verzehrt werden. Ein gründliches Durcherhitzten von Fisch und Meeresfrüchten bis zum Erreichen der entsprechenden Kerntemperatur (mindestens 70°C für 2 min) sollte vor dem Verzehr erfolgen. |
|
Wo liegen zukünftige Herausforderungen? |
|
Steigende Wassertemperaturen aufgrund des Klimawandels führen besonders in der Badesaison zu erhöhten Vibrio-Konzentrationen in vielen Gewässern, wodurch es zukünftig zu einer weiteren Zunahme von Infektionen mit Nicht-Cholera-Vibrionen, wie V. vulnificus und non-O1/non-O139 V. cholerae, kommen kann. Besonders die Ostsee ist aufgrund ihres moderaten Salzgehalts für Infektionen mit V. vulnificus prädestiniert. Die mikrobiologische Überwachung der Badestrände sollte daher um Vibrio spp. erweitert werden. Weiterhin besteht ein Aufklärungsbedarf der an Küstenregionen ansässigen Ärzte sowie ein Informationsbedarf für Einheimische und Urlauber über Infektionsrisiken und Infektionen mit Vibrionen. Zukünftige Herausforderungen liegen auch in der Einführung einheitlicher Richt- und Warnwerte für Vibrio spp. in Lebensmitteln wie Fisch und Fischprodukten sowie Meeresfrüchten in unterschiedlichen Zubereitungsformen. Neben dem spezies-spezifischen Nachweis sollten weitere Virulenzfaktoren, die in der Pathogenese eine entscheidende Rolle spielen, neben den bereits in der DIN EN ISO 21872/2017 genannten Toxinen, detektiert werden. |
|
Weitere Informationen https://www.bfr.bund.de/de/fragen_und_antworten_zu_vibrionen-250184.html https://www.rki.de/SharedDocs/FAQ/Vibrionen/FAQ-Liste.html https://www.who.int/news-room/fact-sheets/detail/cholera https://www.cdc.gov/vibrio/index.html Metelmann, C., Metelmann, B., Gründling, M. et al. (2020). Vibrio vulnificus, eine zunehmende Sepsisgefahr in Deutschland? Anaesthesist 69, 672–678. https://doi.org/10.1007/s00101-020-00811-9 Brehm, T.T., Dupke, S., Hauk, G. et al. (2021). Nicht-Cholera-Vibrionen – derzeit noch seltene, aber wachsende Infektionsgefahr in Nord- und Ostsee. Internist 62, 876–886. https://doi.org/10.1007/s00108-021-01086-x Alter, T., Dieckmann, Dieckmann, R., Hühn, S., Strauch, E. (2012). Pathogene Mikroorganismen: Vibrio. Grundlagen, Nachweis, Relevanz und Präventionsmaßnahmen. BEHR’S…VERLAG. 1. Auflage. ISBN: 978-3-89947-893-8 |
Für die fachliche Unterstützung bei der Erstellung des Vibrionen-Steckbriefes danken wir Dr. Susanne Fleischmann, Prof. Dr. Thomas Alter (Freie Universität Berlin, Institut für Lebensmittelsicherheit und -hygiene) und Dr. Jens André Hammerl (Bundesinstitut für Risikobewertung (BfR), Abteilung Biologische Sicherheit, Konsiliarlabor für Vibrio).
August 2021 - Nipahvirus
Immunfluoreszenzanalyse einer Nipahvirus-infizierten, vielkernigen Riesenzelle (sog. Synzytium). Die Zellkerne sind blau, das virale Nukleoprotein rot und das virale Fusionsprotein grün gefärbt. Copyright: Dr. Sandra Diederich/Dr. Kerstin Fischer
|
Beschreibung |
|
Das Nipahvirus gehört zur Familie der Paramyxoviridae (Gattung Henipavirus). Es ist ein behülltes Virus mit einem einzelsträngigen RNA-Genom negativer Polarität. Es handelt sich um ein hochpathogenes Virus mit einem für Paramyxoviren ungewöhnlich breiten Wirtsspektrum. Das Nipahvirus ist gemäß Biostoffverordnung in die Risikogruppe 4 (höchste Risikogruppe) eingestuft. |
|
Erstmals entdeckt |
|
Der erste Nipahvirus-Ausbruch wurde 1998/99 in Malaysia und Singapur beschrieben. Zum einen wurden hier humane Infektionen mit grippeähnlichen und starken, neurologischen Symptomen beobachtet, die zumeist auf eine Enzephalitis zurückzuführen waren. In etwa 40% der Fälle endeten diese Infektionen tödlich. Zum anderen kam es in lokalen Schweinehaltungen zu fieberhaften, respiratorischen Erkrankungen, wobei auch einige der betroffenen Schweine zentralnervöse Symptome zeigten. Die Übertragung vom Schwein, dem sog. Zwischenwirt, auf den Menschen erfolgte durch direkten Kontakt mit infizierten Tieren und deren Körperflüssigkeiten (Speichel, Urin, Blut). |
|
Wo kommt der Erreger vor? |
|
Der Erreger ist bislang ausschließlich in Südostasien beschrieben. Nach dem ersten Ausbruch in Malaysia und Singapur 1998/99 kommt es seit 2001 zu fast jährlich wiederkehrenden Nipahvirus-Ausbrüchen in Bangladesch und Indien. Allerdings scheint das Schwein als Zwischenwirt bei diesen jüngeren Ausbrüchen keine Rolle zu spielen. Vielmehr wird hier von einer Übertragung des Virus vom Reservoirwirt, dem Flughund, direkt auf den Menschen ausgegangen. Auch Mensch-zu-Mensch-Übertragungen wurden beobachtet. Zudem wird vermutet, u.a. aufgrund von serologischen Untersuchungen, dass nah verwandte, Henipa-ähnliche Viren in Afrika und Südamerika zirkulieren. |
|
Betroffene Tierspezies, Reservoir |
|
Als natürliches Virusreservoir gelten Flughunde der Gattung Pteropus. Hausschweine sind ebenfalls empfänglich. Sie dienten während des ersten Nipahvirus-Ausbruchs in Malaysia 1998/99 als Zwischen- bzw. Amplifikationswirt, was die Übertragung von Nipahviren auf den Menschen ermöglichte. Nipahviren zeichnet zudem ein für Paramyxoviren ungewöhnlich breites Wirtsspektrum aus. Weitere Tierspezies, die als empfänglich für eine Nipahvirus-Infektion beschrieben werden, sind z.B. Hamster, Frettchen, Katzen, Hunde, Wiederkäuer und Pferde. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Der Mensch kann sich u.a. durch den direkten Kontakt mit Nipahvirus-infizierten Schweinen anstecken. Neben Kontakt mit kontaminierten Geweben können auch virushaltige Körperflüssigkeiten wie Speichel, Urin und Blut als Infektionsquelle dienen. Daher infizierten sich während des ersten Ausbruchs in Malaysia auch vorwiegend Personen, die z.B. in Schlachthöfen arbeiteten. Bei den Ausbrüchen in Bangladesch und Indien scheint die Hauptinfektionsquelle für den Menschen der Verzehr von frischem Dattelpalmsaft zu sein, der mit Urin oder Speichel von infizierten Flughunden verunreinigt ist. Gleichzeitig wurde in diesen Ländern auch eine direkte Übertragung von Mensch zu Mensch festgestellt. Allerdings bleibt unklar, ob diese Übertragbarkeit durch kulturelle Praktiken oder durch Unterschiede in der Pathogenität des Virus bedingt ist. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Flughunde dienen als Virusreservoir und weisen keine klinischen Symptome auf. Die Mehrzahl der Infektionen bei Schweinen verläuft asymptomatisch. Symptomatische Fälle zeigen hingegen akutes Fieber, erschwerte Atmung und neurologische Symptome wie Zittern, Zuckungen und Muskelkrämpfe. Der klinische Verlauf der Krankheit variiert jedoch je nach Alter. Sauen zeigen eher eine neurologische Erkrankung und sterben teilweise plötzlich und ohne erkennbare Anzeichen. Bei Absetzern und Ferkeln überwiegen respiratorische Symptome, die häufig von einem heftigen, unproduktiven (laut bellenden) Husten begleitet werden. Mit Ausnahme von jungen Ferkeln ist die Sterblichkeit bei Schweinen eher gering (weniger als 5%). Allerdings könnten die höheren Sterblichkeitsraten bei Ferkeln auch indirekt auf eine Infektion der Sau und die daraus resultierende Unfähigkeit, die Ferkel effektiv zu säugen, hindeuten. Eine Nipahvirus-Infektion kann auch beim Menschen asymptomatisch verlaufen. Häufiger führt sie jedoch zu klinischen Manifestationen, die von Fieber, Muskelschmerzen und Erbrechen bis hin zu Lungenentzündung und Enzephalitis begleitet sind. Chronische neurologische Symptome und rezidivierende oder wiederkehrende Enzephalitis mit starken Kopfschmerzen, Benommenheit, unklarer Sprache bis hin zu Ohnmacht und Koma sind bekannt. Je nach Virusisolat kann die Mortalität beim Menschen zwischen 40 und 100% erreichen |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt derzeit noch keine zugelassenen Impfstoffe oder Medikamente zur Prävention bzw. Behandlung einer Nipahvirus-Infektion. Der humane, monoklonale Antikörper m102.4, der das Nipahvirus effektiv in vitro neutralisiert, wurde in in vivo Experimenten u.a. an infizierten Primaten, bereits erfolgreich zur Behandlung eingesetzt. Eine klinische Studie der Phase 1 wurde mittlerweile erfolgreich absolviert. Für das nah verwandte Hendravirus, welches in Australien vorkommt und von Flughunden über das Pferd als Zwischenwirt auf den Menschen übertragen werden kann, existiert ein kommerzieller Impfstoff (Equivac®HeV) für die Anwendung beim Pferd. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
In betroffenen Gebieten werden regelmäßig Beprobungen von Haus-, Nutz- und Wildtierpopulationen durchgeführt. Die gewonnenen Proben werden serologisch und molekularbiologisch untersucht, um z.B. ein akutes Infektionsgeschehen frühzeitig zu detektieren oder den Grad der Durchseuchung zu bestimmen. Zusätzlich werden vergleichbare Studien auch in anderen Gebieten, u.a. Afrika und Südamerika, durchgeführt, um das potentielle Vorkommen zu untersuchen und eine mögliche Verbreitung des Erregers frühzeitig zu erkennen. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
Welche Bekämpfungsstrategien gibt es? |
|
Eine frühzeitige Erkennung eines Ausbruchs ist wichtig, um das Risiko für eine Übertragung auf den Menschen zu minimieren und damit schwerwiegende Krankheitsverläufe zu verhindern. Gleichzeitig trägt eine frühzeitige Erkennung dazu bei, den Eintrag sowie die Ausbreitung innerhalb einer Schweinehaltung zu vermeiden und somit auch die Folgeschäden so gering wie möglich zu halten. Während des ersten Ausbruchs der Erkrankung in Malaysia 1998/99 wurde die Ausbreitung der Infektion durch eine Vielzahl von Maßnahmen eingedämmt. Dazu gehörten die Sperrung infizierter Schweinebetriebe, die Kontrolle von Tierbewegungen, die Keulung von Schweinen, das Vergraben oder Verbrennen infizierter Kadaver und die Dekontamination. Fast 1 Million Schweine wurden letztendlich gekeult, was für die lokale Schweineindustrie einen enormen ökonomischen Schaden bedeutete. |
|
Wo liegen zukünftige Herausforderungen? |
|
Der natürliche Lebensraum der Reservoirtiere wird z.B. durch Landnutzungsänderungen und konventionelle Landwirtschaft zunehmend eingeschränkt. Neben der lokalen landwirtschaftlichen Praxis, Obstbäume in der Nähe von Schweineställen zu pflanzen, gilt das Vordringen von Schweinefarmen in verbliebene Lebensräume der Flughunde als ein Faktor, der zum ersten Nipahvirusausbruch in Malaysia beitrug. Das Verbringen von asymptomatisch infizierten Schweinen im Rahmen des Handels ermöglichte zudem die Verbreitung des Virus über Ländergrenzen. Die Erhaltung des Lebensraums von Wildtieren, insbesondere Flughunden, sollte aus ökologischer und infektionsbiologischer Sicht darum oberste Priorität haben. Ein weiterer, wichtiger Baustein in der Infektionsprävention ist die Aufklärung der in den betroffenen Gebieten lebenden Menschen über zugrundeliegende Übertragungsmechanismen. Dabei kann es in der Folge eine Herausforderung sein, bestimmte Gewohnheiten aufgrund möglicher Infektionsrisiken anzupassen oder zu unterlassen, wie z.B. das Trinken von rohem Dattelpalmsaft bzw. der zusätzliche Schutz von Sammelbehältnissen, sodass diese nicht durch Flughundsekrete (Speichel, Urin) verunreinigt werden. Eine weitere Herausforderung bleibt zudem die Entwicklung eines wirksamen Impfstoffs für die Anwendung im Bereich der Veterinär- sowie im Bereich der Humanmedizin. |
Für die Erstellung des Steckbriefes zum Nipahvirus danken wir Dr. Kerstin Fischer und Dr. Sandra Diederich vom Institut für neue und neuartige Tierseuchenerreger am Friedrich-Loeffler-Institut, Insel Riems
Juli 2021 - Streptococcus suis
Abbildung: Kolorierte elektronen-mikroskopische Aufnahme von HEp-2-Zellen, die mit Streptococcus suis infiziert wurden (Manfred Rohde, Zentrale Einheit für Mikroskopie, Helmholtz-Zentrum für Infektionsforschung, Braunschweig)
|
Beschreibung |
|
Streptococcus suis ist ein grampositives, kugelförmiges, bekapseltes Bakterium, das typischerweise in Ketten angeordnet ist. Dieser fakultativ pathogene Erreger ist ein häufiger Kommensale im oberen Respirationstrakt von Schweinen, der aber auch schwere systemische Erkrankungen hervorrufen kann und so weltweit zu enormen wirtschaftlichen Verlusten in der Schweineindustrie führt. Zudem spielt er eine immer bedeutendere Rolle als Zoonoseerreger. S. suis kann bei 37°C sowohl unter aeroben als auch unter anaeroben Bedingungen angezüchtet werden und zeigt auf Blutagar eine „vergrünende“ Hämolyse (α-Hämolyse); manche Stämme können auch eine vollständige Hämolyse verursachen. Sowohl genetisch als auch phänotypisch ist S. suis eine sehr heterogene Spezies. Anhand der antigenen Eigenschaften der Polysaccharidkapsel kann man über 30 verschiedene Serotypen unterscheiden, wobei Serotyp 2 weltweit am häufigsten mit Erkrankungen beim Schwein und beim Menschen assoziiert werden kann. S. suis ist mit einer Vielzahl Virulenz(-assoziierter)-faktoren ausgestattet. Die Polysaccharidkapsel, die das Bakterium vor phagozytierenden Zellen schützt, und das sezernierte Toxin Suilysin, welches verschiedene Zelltypen durch Porenbildung schädigen kann, sind nur zwei Beispiele. Da es sich bei S. suis um einen fakultativ pathogenen Erreger handelt, braucht er zur Etablierung einer Infektion einen Wegbereiter (z.B. vorangegangene Infektion mit einem anderen Erreger, Immunsuppression), der es ihm ermöglicht, die Barriere des Atemwegepithels zu überwinden, um sich dann hämatogen/lymphogen im gesamten Organismus ausbreiten zu können. |
|
Erstmals entdeckt |
|
Berichten zufolge wurde S. suis erstmals in den frühen 1950er Jahren in Europa (England, Niederlande) aus Schweinen isoliert, die an Meningitis, Septikämie oder eitriger Arthritis erkrankt waren. Einige Zeit später, im Jahr 1968, diagnostizierte man den ersten Fall beim Menschen in Dänemark und kurz darauf wurden weitere Fälle in Nordeuropa und Hong Kong bekannt. Allerdings wurde S. suis erst 1987 offiziell als neue Spezies anerkannt. |
|
Wo kommt der Erreger vor? |
|
S. suis besiedelt hauptsächlich den oberen Respirationstrakt (v.a. Tonsillen und Nasenhöhle) von Schweinen, ohne dabei zwingend eine Erkrankung auszulösen (subklinische Carrier). Außerdem kann S. suis die Schleimhaut im Genitaltrakt von Sauen besiedeln, und auch eine Kolonisation des Intestinaltraktes von Schweinen kann nicht ausgeschlossen werden. Durch den Transport von subklinisch infizierten Tieren wird der Erreger in andere (naive) Herden eingeschleppt. Innerhalb einer Herde spielt die horizontale Übertragung durch direkten Kontakt der Tiere oder über Aerosole, sowie die vertikale Übertragung von Sauen auf Ferkel während der Geburt eine Rolle. In der Umwelt (Wasser, Fäkalien, Staub, Tierkadavern) ist S. suis eine gewisse Zeit lang überlebensfähig, sodass er auch in der Umgebung (z.B. auf Futtertrögen) der Tiere nachgewiesen werden konnte. Außerdem kann eine Übertragung über Vektoren (z.B. Fliegen) bislang nicht ausgeschlossen werden. |
|
Betroffene Tierspezies, Reservoir In erster Linie ist S. suis ein Erreger, der sich an das Schwein als Wirt angepasst hat. Obwohl die Prävalenz in der Schweinepopulation enorm hoch ist (diese liegt weltweit bei fast 100%!), kommt es doch vergleichsweise selten zu schweren klinischen Erkrankungen (Inzidenz < 5%). Eine Erkrankung tritt vor allem bei Absatzferkeln (5-10 Wochen alt) auf, wenn der Schutz durch maternale Antikörper nachlässt. Aber auch bei erwachsenen Tieren spielt S. suis eine Rolle als sekundärer Erreger einer Bronchopneumonie im Zusammenspiel mit anderen viralen/bakteriellen Erregern (z.B. Schweineinfluenza-Virus, Porzines Reproduktives und Respiratorisches Syndrom Virus, Bordetella bronchiseptica, Actinobacillus pleuropneumoniae). Klinisch inapparente Tiere (Carrier) fungieren als Erregerreservoir und stellen eine wichtige Infektionsquelle für andere Schweine und den Menschen dar. Berichten zufolge wurde S. suis auch in Wildschweinen und anderen Spezies (z.B. Kaninchen, Lämmer, Hunde) diagnostiziert. Deshalb sollte man auch andere Tierarten als potentielle Ansteckungsquelle in Betracht ziehen. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Der Mensch kann sich entweder über den Verzehr von kontaminierten und nicht durcherhitzten Schweineprodukten oder über Verletzungen der Haut bei direktem Kontakt zu infizierten Schweinen oder kontaminierten Schweineprodukten mit S. suis infizieren. Zur Risikogruppe zählen demzufolge Personen, die einen engen Kontakt zu Schweinen oder Schweineprodukten haben (z.B. Landwirte, Tierärzte, Viehtransporteure, Schlachthofpersonal, Metzger). Allerdings treten im westlichen Raum nur sporadisch Fälle humaner Infektionen mit S. suis auf. Im Gegensatz dazu sind Menschen im asiatischen Raum besonders gefährdet, sich mit diesem Erreger zu infizieren. Dies ist zum einen mit der dortigen Essenskultur zu erklären, da in einigen Ländern rohes Schweinefleisch und auch Schweineblut verzehrt wird. Des Weiteren spielen der Verkauf von rohem Schweinefleisch auf Straßenmärkten und die traditionelle Haltung und Schlachtung von Schweinen „im Hinterhof“ eine wichtige Rolle, die einen sehr engen Kontakt zu den Tieren und rohem Schweinefleisch mit sich bringt. So hat ebendiese Form der Schweineproduktion 1998 und 2005 zu einem Ausbruch von humanen S. suis-Infektionen in der Sichuan-Provinz in China geführt, der parallel zu einem Ausbruch in der Schweinepopulation verlief und bei dem zahlreichen Menschen starben. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Wenn S. suis die Epithelbarriere im Respirationstrakt überwindet und sich systemisch ausbreitet, dann zeigt sich dies bei den Ferkeln zunächst durch Fieber, begleitet von einer Bakteriämie oder Septikämie, die unbehandelt bis zu drei Wochen andauern kann. In dieser Phase kommt es zu wechselndem Fieber, Anorexie, Depression und Lahmheit; in perakuten Fällen können die Tiere auch plötzlich versterben. Einige Tiere zeigen zentralnervöse Symptome (fehlende Koordination, fehlendes Stehvermögen, Paddeln, Opisthotonus, Krampfen, Nystagmus) aufgrund einer Meningitis. Weitere klinische Manifestationen umfassen Arthritis, Endokarditis, Rhinitis, Pneumonie oder Polyserositis. Beim Menschen ist die häufigste klinische Manifestation einer S. suis-Infektion die Meningitis, welche durch Kopfschmerzen, Fieber, zentralnervöse Symptome und später auch durch Verlust des Hörvermögens gekennzeichnet ist. Außerdem zeigen einige Patienten Symptome einer Sepsis, wie z.B. Petechien, Ekchymosen oder Purpura. Selten kommen auch Endokarditis, Arthritis und Endophthalmitis vor. Bei den Ausbrüchen in China, die mit einer ungewöhnlich hohen Morbidität und Mortalität einhergingen, handelte es sich in vielen Fällen um eine Sepsis und das daraus resultierende Toxic shock-like syndrome, welches zu einem Multiorganversagen führt.
Abb. 2: S. suis Infektion bei Mensch und Schwein, angepasst aus Segura et al., 2017, Trends in Microbiology |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Humane S. suis Infektionen werden mit Antibiotika wie Penicillin oder Ceftriaxon behandelt. Auch eine Kombination mehrerer Präparate ist möglich. Zusätzlich kann eine Therapie mit Dexamethason das Risiko eines Hörverlustes durch die Infektion senken. Bei Patienten mit septischem Schocksyndrom sind weitere intensivmedizinische Maßnahmen erforderlich. Die Behandlung beim Schwein erfolgt ebenso durch Antibiotika. Zu den am häufigsten verwendeten Mitteln zählen die β-Lactame wie Penicillin, Ceftiofur oder Amoxicillin, aber auch andere Antibiotika wie Aminoglykoside oder Amphenicole werden eingesetzt. Trotz der weltweiten Nutzung von β-Laktam-Antibiotika sind viele der klinisch relevanten Stämme weiterhin sensibel gegenüber dieser Antibiotika-Gruppe; resistente Stämme in dieser Kategorie finden sich vor allem unter den Kommensalen. Insgesamt wurden diverse Resistenzen von S. suis Isolaten in den letzten Jahren beschrieben. Diese umfassen Resistenzen gegen Penicillin, Tetrazykline, Erythromycin, Trimethoprim/Sulfamethoxazol und Florfenicol. Trotz intensiver Forschung ist bislang kein kommerzieller Impfstoff gegen S. suis zugelassen. Die hohe genomische, phänotypische und geographische Diversität dieses Erregers machen die Entwicklung einer universalen kreuzprotektiven Vakzine zu einer besonderen Herausforderung. Nichtsdestotrotz ist die genomische Variabilität unter klinischen Isolaten geringer als bei nicht-klinischen Stämmen, so dass das Ziel eines universellen Impfstoffes erreichbar scheint. Im Feld werden heute vor allem autogene Vakzine eingesetzt. Für ihre Entwicklung wird S. suis aus dem betroffenen Betrieb isoliert, in einem lizensierten Labor inaktiviert und zu einem Impfstoff verarbeitet. Autogene Vakzine sind somit betriebs- und stammspezifisch. Ihre Effektivität beruht auf der Menge genutzter Bakterien, der Inaktivierungsmethode sowie den verwendeten Adjuvantien. Die Protokolle variieren von Labor zu Labor. In der Literatur finden sich keine einheitlichen Angaben zur Wirksamkeit autogener Vakzine, weshalb weitere Studien in diesem Bereich dringend nötig sind. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Die Erkrankung mit S. suis ist nicht meldepflichtig. Somit gibt es kein staatliches Überwachungssystem für diese Erkrankung in Deutschland. Es existieren mehrere molekulare Überwachungswerkzeuge, die auf der Sequenzierung entsprechender Isolate beruhen. Als Goldstandard für die Ermittlung der Populationsstruktur von S. suis wird die Multi-Locus-Sequenztypisierung (MLST) angesehen. Diese Methode untersucht die genetische Variation innerhalb sogenannter Haushalts-Gene und trifft somit eine Aussage über die genomische Diversität des Erregers. Die Ganzgenomsequenzierung hingegen wird dafür genutzt, Isolate anhand ihrer Virulenz in verschiedene Gruppen einzuordnen. In den letzten Jahren wurden viele Studien aus verschiedenen Ländern (u. a. Deutschland, Schweiz, Vereinigtes Königreich, China, Nordamerika) publiziert, welche Aufschluss über die weltweite Prävalenz und Populationsstruktur von S. suis in Schweinebeständen sowie teilweise auch im Wildschwein geben. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Obwohl S. suis weltweit als einer der bedeutendsten Erreger in der Schweinehaltung gilt, ist das Wissen über die Epidemiologie und Pathogenität dieses Erregers noch immer limitiert. Aktuelle Forschungsfragen konzentrieren sich deshalb auf das Erlangen eines besseren Verständnisses über die Interaktionen zwischen Wirt, Pathogen und Umwelt. Genomweite Assoziationsstudien geben Aufschluss über die globale genomische Vielfalt sowie die Evolution pathogener Stämme. Außerdem werden Gene identifiziert, die an der Virulenz und Kolonisierung beteiligt sind oder eine hohe Konservierung innerhalb klinischer Isolate aufweisen. Diese dienen dann als Ausgangspunkt für die Entwicklung eines universellen Impfstoffs. Die Impfstoffentwicklung stellt somit einen weiteren Schwerpunkt in der S. suis-Forschung dar. Ein universeller Impfstoff muss ein Antigen enthalten, dass auf Proteinebene hochkonserviert in allen Stämmen ist. Allerdings zeigt nur die Hälfte der Proteine in den gewöhnlich vorkommenden S. suis-Isolaten eine Proteinidentität von mindestens 80%. Die Übereinstimmung unter invasiven Stämmen liegt etwas höher. Des Weiteren wird die Rolle der Mikrobiota bei der Entwicklung einer Infektion mit S. suis untersucht. Das Ziel ist es, geeignete Kommensalen zu finden, die für die Aufrechterhaltung einer gesunden Flora wichtig sind und Erreger vielleicht sogar verdrängen können (competitive exclusion). Da S. suis oft als sekundärer Krankheitserreger in Erscheinung tritt, spielen Co-Infektionen eine bedeutende Rolle. Es werden sowohl Co-Infektionen mit Viren als auch mit anderen Bakterien in verschiedenen in vivo- und in vitro-Ansätzen analysiert. Ein weiterer Forschungsschwerpunkt ist die Entwicklung neuer diagnostischer Methoden zur Unterscheidung krankmachender (virulenter) von avirulenten Stämmen |
|
Welche Bekämpfungsstrategien gibt es? |
|
Da eine vollständige Eliminierung der Campylobacter-Kontamination aus den Lebensmittelproduktionsketten derzeit nicht möglich ist, ist derzeit das Ziel, Bekämpfungsmaßnahmen zur Minimierung des Vorkommens von Campylobacter spp. in den Beständen zu etablieren und die quantitative Belastung von Tieren und Lebensmitteln mit Campylobacter zu senken. Hierzu erscheint eine Kombination mehrerer Verfahren auf verschiedenen Stufen der Lebensmittelkette (schwerpunktmäßig im Geflügelsektor) am erfolgversprechendsten. Interventionsmaßnahmen im Primärproduktionsbereich müssen darauf gerichtet sein, den Eintrag von Campylobacter in die Bestände zu verhindern und die quantitative Belastung zu senken (z. B. durch Optimierung der Haltungsbedingungen, Futter- und Wasserzusätze oder Phagenapplikation). Am Schlachthof kann durch technologische Verfahren die fäkale Kontamination von Fleisch mit Campylobacter reduziert werden. Diese Maßnahmen müssen durch Informationen von Produzenten und Verbrauchern begleitet werden. Für die Verbraucher spielt in der Infektionsvermeidung eine gute Küchenhygiene und die Hygiene bei der Verarbeitung von Lebensmitteln eine besondere Rolle. Neue klinische Aspekte und molekulare Konzepte der Erkrankungen beim Menschen, die in Form von neuen Mausinfektionsmodellen bereitgestellt werden, vervollständigen das Portfolio. |
|
Wo liegen zukünftige Herausforderungen? |
|
S. suis ist ein früher Kolonisierer der nasalen Schleimhaut. Die Ferkel werden bereits während oder kurz nach der Geburt besiedelt. Da es sich bei diesem Erreger um einen Kommensalen im porzinen Atemtrakt handelt, sollte die optimale Bekämpfungsstrategie virulente Stämme eliminieren, ohne das Gleichgewicht der mukosalen Mikrobiota zu beeinträchtigen. Trotzdem basiert die Bekämpfung von S. suis noch oft auf einem alarmierend hohen Einsatz von Antibiotika, welches nicht nur ein erhöhtes Risiko der Resistenzentwicklung, sondern auch negative Effekte auf die natürliche Mikrobiota und das Immunsystem der Tiere mit sich bringt. Um den (inzwischen u. a. in Deutschland nicht mehr zulässigen!) prophylaktischen und metaphylaktischen Einsatz von Antibiotika zu reduzieren, sollten sich Präventionsmaßnahmen vor allem auf das Management prädisponierender Faktoren fokussieren. Zu den prädisponierenden Faktoren gehören ein schlechtes Stallklima (mangelnde Belüftung, Überbelegung, Temperaturschwankungen), ein schlechtes Hygienemanagement (kein Rein-Raus-Verfahren, mangelnde Desinfektionsmaßnahmen), Stress der Tiere sowie die Infektion mit anderen primären Atemwegserregern als Wegbereiter. Zusätzlich spielen autogene Impfungen in der Bekämpfung von S. suis Infektionen eine bedeutende Rolle. Für die Bekämpfung von humanen S. suis Infektionen sind insbesondere eine gute Schlachthygiene, ausreichende Schutzkleidung (z.B. Handschuhe) bei der Fleischuntersuchung oder dem Umgang mit infizierten Tieren und der Verzehr von ausschließlich durchgegartem Schweinefleisch von Bedeutung. Um die Situation in Asien zu verbessern, ist eine ausreichende Aufklärung der Bevölkerung über die Risiken und Infektionswege der Erkrankung sowie eine Verbesserung der dortigen Haltungsbedingungen notwendig. |
|
Weitere Informationen https://www.schweinegesundheitsdienste.de/services/files/Streptokokken-Hygienemanager.pdf https://www.3drei3.de/artikel/streptococcus-suis-die-suche-nach-einer-losung_2568/ https://www.who.int/foodsafety/areas_work/zoonose/strepsuis/en/ https://www.pigss-horizon2020.eu/ https://www.mdpi.com/2076-0817/9/5/374 https://www.msdvetmanual.com/generalized-conditions/streptococcal-infections-in-pigs/streptococcus-suis-infection-in-pigs |
Für die fachliche Unterstützung bei der Erstellung des Streptococcus suis-Steckbriefes danken wir Désirée Vötsch und Muriel Dresen von der Stiftung Tierärztliche Hochschule (TiHo) Hannover.
Juni 2021 - BSE
(oben) Typische pathomorphologische Läsionen im Gehirn eines klinisch an BSE erkrankten Rindes, die spongiforme Auflockerung des Neuropils ist deutlich erkennbar, fokal ist zudem ein Amyloider Plaque nachweisbar, Hämatoxylin&Eosin Färbung, (unten) Massive diffuse Ablagerung des pathologischen Prion-Proteins (in Braun) im Gehirn eines BSE erkrankten Rindes, Immunhistologie, monoklonaler Antikörper L42 (Bilder: Dr. Christine Fast, NRL TSE)
|
Beschreibung |
|
|
Die Bovine spongiforme Enzephalopathie (BSE) ist eine Prionerkrankung und gehört damit zur Gruppe der Transmissiblen Spongiformen Enzephalopathien (TSE), die wiederum den Proteinfehlfaltungskrankheiten zugeordnet werden. Nach der Protein-Only-Hypothese von Stanley Pruisiner ist eine fehlgefaltete, infektiöse Form (PrPSc) des körpereigenen zellulären Prion-Proteins (PrPc) der Auslöser der Erkrankung, indem es dessen Umfaltung induziert. Die dabei entstehenden massiven Ablagerungen des PrPSc im Zentralem Nervensystem sind das Kennzeichen der Erkrankung und verantwortlich für das klinische Erscheinungsbild. |
|
|
Erstmals entdeckt |
|
|
Die Erstbeschreibung der BSE erfolgte 1985 durch Gerald Wells, einem Veterinärpathologen des Central Veterinary Institute, Weybridge in England. Ihm und seinem Team fiel das gehäufte Auftreten einer neuen Erkrankung in Rindern auf, die mit einer schwammartigen Auflockerung des Gehirns einhergeht. Das histopathologische Bild entsprach den bereits von anderen TSEs bekannten Erscheinungsbild, wie zum Beispiel der seit Jahrhunderten bekannten Scrapie im Schaf. Im Jahr 1996 erfolgte erstmals die offizielle Erklärung, dass eine Übertragung der BSE auf den Menschen nicht ausgeschlossen werden kann und 2004 wurden zwei weitere Formen der Erkrankung entdeckt (H- und L-Typ der Atypischen BSE), die jedoch als sporadische, nicht übertragbare Altersveränderung eingestuft werden. |
|
|
Wo kommt der Erreger vor? |
|
|
Als wichtigster Übertragungsweg der BSE wird die Verfütterung von infektiösen Tiermehl angesehen. PrPSc ist sehr resistent gegenüber verschiedensten Umwelteinflüssen, so dass die vorhergehende Senkung der Verarbeitungstemperatur bei der Herstellung von Tiermehl im Vereinigten Königreich zu einer nicht ausreichenden Inaktivierung des Erregers geführt hat. Die Verwertung dieses Ausgangsmaterials, d.h. die Verfütterung von Rindermehl an Rinder, hat nachfolgend im Vereinigten Königreich die ersten BSE-Erkrankungen ausgelöst. Darüber hinaus wurden auch entsprechende Zusätze von tierischen Eiweißen und Fetten im Milchaustauscherfutter von Kälbern als Quelle der Erkrankung angesehen. |
|
|
Betroffene Tierspezies, Reservoir |
|
|
Natürliche Infektionen mit der BSE sind bei Rindern, Ziegen und Katzen bekannt. Experimentell ist eine Vielzahl von Tierarten infizierbar, neben Schafen z.B. auch Nagetiere. |
|
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
|
Der Mensch infiziert sich durch die Aufnahme kontaminierter Nahrung. Die Empfänglichkeit für TSE-Erkrankungen weist beim Menschen, abhängig vom Aufbau des zellulären, körpereigenen Prion-Proteins eine starke genetische Komponente auf, die zu einer unterschiedlich stark ausgeprägten Empfänglichkeit/Resistenz gegenüber einer TSE-Infektion führen kann. |
|
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
|
Die BSE zeichnet sich durch einen protrahierten Verlauf mit langer Inkubationszeit aus. Daher sind nur erwachsene Tiere betroffen, das mittlere Alter betroffener Tiere liegt bei fünf Jahren. Auffällig sind die Verhaltensänderungen, die zunächst auch intermittierend auftreten können. Die Tiere sind nervös und schreckhaft, zeigen Bewegungsstörungen und reagieren überempfindlich auf Berührungen, Lärm und Licht. Das durch die BSE im Menschen ausgelöste Krankheitsbild wird als Variante Creutzfeldt-Jakob-Krankheit bezeichnet. Im Gegensatz zu der sporadischen Form der Erkrankung entwickeln sich die Symptome bei deutlich jüngeren Menschen (<30 Jahre). Die durchschnittliche Erkrankungsdauer liegt bei ca. 14 Monaten. Die Patienten zeigen in der Regel zunächst psychiatrische Symptome wie Angst und Depression, im weiteren Verlauf werden Demenz und neurologische Ausfälle (Krampfanfälle, Ataxien etc.) beobachtet. |
|
|
Gibt es Medikamente oder einen Impfstoff? |
|
|
TSEs sind nicht behandelbar und führen immer zum Tod des Tieres bzw. des Menschen. Da es sich bei dem Erreger um ein Eiweiß handelt, dass keinerlei spezifische Immunreaktion auslöst, ist auch eine Vakzinierung nicht möglich. |
|
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
|
Die BSE ist eine anzeigepflichtige Tierseuche. Die Bekämpfung und Überwachung der BSE erfolgt auf Grundlage der EU-Verordnung (EG) 999/2001. In Deutschland bedeutet das, das alle Risikotiere ab einer bestimmten Altersgruppe einem Schnelltest zum Nachweis des PrPSc im Gehirn unterzogen werden müssen. Darüber hinaus wird das sogenannte Spezifizierte Risikomaterial (SRM) bei der Schlachtung von Rindern und kleinen Wiederkäuern entfernt und als Tierisches Nebenprodukt der Kategorie 1 unschädlich beseitigt. Dabei handelt es sich um Körperteile bzw. Gewebe die das PrPSc enthalten könnten. |
|
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
Trotz umfangreicher Forschung seit 1985 ist der Ursprung der BSE, d.h. der Ursprung des ersten PrPSc, dass unzureichend inaktiviert im Vereinigten Königreich erstmals in das Tiermehl gelangt ist, noch ungeklärt. Darüber hinaus ist es interessant, ob und inwieweit sich die BSE während einer Passage in anderen Spezies adaptiert und inwieweit ein sicherer Nachweis in solchen Fällen zu führen ist. Auch die Bedeutung der Atypischen BSE Formen ist noch nicht vollständig geklärt. Im Gegensatz zur Scrapie und anderen TSEs ist die BSE in ihrer Ausbreitung im Tierkörper eng auf das Nervensystem beschränkt, welche Zellen dabei insbesondere eine Rolle spielen und welche Faktoren die stark variable Inkubationszeit beeinflussen ist jedoch ebenfalls unbekannt. Darüber hinaus gilt für alle TSEs, dass bisher noch keine eindeutige Erklärung für die pathomorphologisch sichtbaren Läsionen gefunden werden konnte. |
|
|
Welche Bekämpfungsstrategien gibt es? |
|
|
Die Bekämpfung der BSE beruht auf den klaren Vorgaben des Überwachungssystems (siehe oben). Betroffene Tiere werden umgehend getötet und unschädlich beseitigt. Darüber hinaus existiert ein Verfütterungsverbot von Futtermitteln an Wiederkäuer, die verarbeitetes tierisches Eiweiß enthalten. |
|
|
Wo liegen zukünftige Herausforderungen? |
|
|
Trotz des seit 2001 bestehenden Verfütterungsverbotes treten sehr vereinzelt Klassische BSE Fälle auf, die es zu erkennen gilt, um einen adäquaten Verbraucherschutz zu gewährleisten und eine neue BSE Epidemie zu verhindern. Es ist daher von entscheidender Bedeutung, dass das derzeit angewandte System der aktiven Surveillance von Risikotieren beibehalten wird. |
|
|
Sonstiges |
|
|
Weitere Informationen zur BSE finden sich auch auf den Seiten des BMEL |
Für die Erstellung des Steckbriefes zu BSE danken wir Dr. Christine Fast (Nationales Referenzlabor für Transmissible Spongiforme Enzephalopathien (TSE), Friedrich-Loeffler-Institut, Insel Riems).
Mai 2021 - Campylobacter
Abbildung: Rasterelektronenmikroskopische Aufnahme einer Zelle des Campylobacter jejuni-Stamms 81-176. Copyright Prof. Dr. Steffen Backert (Boehm et al. 2012, Gut Pathogens, 4:3)
|
Beschreibung |
|
Bakterien der Gattung Campylobacter sind uni- oder bipolar monotrich begeißelte, spiralförmige Stäbchenbakterien, die sich nach Gram negativ (Rot) färben. Die optimale Wachstumstemperatur der für den Menschen besonders gefährlichen thermophilen Arten C. jejuni und C. coli, die an die normale Körpertemperatur von Vögeln (39-42 °C) adaptiert sind, beträgt bis zu 45 °C. Alle Campylobacter-Arten sind microaerophil und wachsen bei reduzierter Sauerstoff-Konzentration von 5 % in einer Atmosphäre mit erhöhtem Kohlendioxid-Gehalt von 10 %. Die bei Infektionen des Menschen besonders häufigen Arten C. jejuni und C. coli sind weltweit Ursache für lebensmittelbedingte bakterielle infektiöse Gastroenteritiden. Dieser Steckbrief fasst einige Eigenschaften der für den Menschen gefährlichsten Campylobacter-Arten zusammen und weist auf aktuelle Trends bei der Bekämpfung der Campylobacteriose hin. |
|
Erstmals entdeckt |
|
Die damals nicht kultivierbaren spiralförmigen Campylobacter-Bakterien wurden in Assoziation mit einer Enteritissymptomatik wahrscheinlich 1886 von Theodor Escherich in Stuhlproben und Dickdarmschleim von Neugeborenen sowie von jungen Kätzchen erstmals beschrieben. Der kulturelle Nachweis und die permanente Kultur der Bakterien waren zunächst nicht erfolgreich. Dreißig Jahre später folgte die Isolierung ähnlicher spiralförmiger Bakterien aus abortierten Schafföten. Nach weiteren Berichten „Vibrio-ähnlicher“ Bakterien im Zusammenhang mit Erkrankungen bei Rind, Schaf und Schwein wurde in den 1970er der Nachweis von Campylobacter-Arten als Durchfallerreger beim Menschen erbracht. Mit der Entwicklung spezieller Nährmedien, die den besonderen metabolischen Eigenschaften der Bakterien Rechnung tragen, wurde ein kausaler Zusammenhang zwischen Erkrankungssymptomatik und bakterieller Infektion möglich. In der Folge wurden die Bakterien der Gattung Campylobacter phylogenetisch den Epsilonproteobacteria zugeordnet, die genetisch besonders variabel sind und zu denen auch die weltweit sehr häufigen gastrointestinalen Krankheitserreger der nahe verwandten Gattung Helicobacter gehören. |
|
Wo kommt der Erreger vor? |
|
Die Arten des Genus Campylobacter sind in der Darmflora von warmblütigen Tieren, in Oberflächengewässern und in der Umwelt global verbreitet. Die meisten Spezies können Erkrankungen bei Menschen und/ oder Tieren auslösen |
|
Betroffene Tierspezies, Reservoir |
|
Für die Erkrankungen beim Menschen spielt das Geflügel als Hauptreservoir für C. jejuni die größte Rolle. Bei den Tieren finden sich nur in seltenen Fällen Symptome, da die durch die Bakterien ausgelösten Entzündungsreaktionen durch anti-inflammatorische Zytokine kompensiert werden. Somit können sich die Krankheitserreger unauffällig in Geflügelbeständen etablieren, ohne dass es zu veterinärmedizinischen Interventionen kommt. Für den Transfer der Campylobacteriose als klassische Zoonose zum Menschen sind aber auch Rinder und in geringerem Umfang Schweine von Bedeutung, die ebenfalls im Laufe der Mast oder der Milchproduktion keine oder nur schwach ausgeprägte Symptome zeigen |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Aus den oben genannten Zusammenhängen bezüglich der Reservoirtiere wird deutlich, dass sich der Mensch in der Mehrzahl der Fälle über Geflügelprodukte infiziert. Das wird auch durch die Meldezahlen in den Ländern mit entsprechenden Meldesystemen so bestätigt. Über den Konsum von Rohmilch und nicht durchgegartem Fleisch sind aber auch Rinder, kleine Wiederkäuer und Schweine Ausgangspunkt für eine Campylobacteriose beim Menschen. Die bedeutendsten Risikofaktoren sind der Verzehr von unzureichend erhitztem Geflügelfleisch und Mängel in der Küchenhygiene. Weiterhin stellen das Baden in Oberflächengewässern, die mit Kot von Wildvögeln kontaminiert sind, und Tätigkeiten in Kläranlagen oder in der Sanierung von Abwassersystemen Infektionsrisiken dar. Bei kleinen Kindern findet sich in vielen Studien das Spielen auf sandigen Spielplätzen als Risikofaktor. Auch hier sind Wildvögel die Ursache der Kontamination solcher Spielplätze |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Zu den Symptomen einer intestinalen Campylobacteriose beim Menschen gehören Bauchschmerzen, Durchfall mit Blutbeimengungen und Fieber. Der klinische Verlauf der Enteritis ist mit bis zu einer Woche für die Betroffenen schwerwiegend - aber meist selbstlimitierend. Einige Infizierte entwickeln schwere postinfektiöse Autoimmunerkrankungen, die das Nervensystem, die Gelenke und den Darmtrakt betreffen. Zu den Komplikationen der Camplyobacteriose zählen das Guillain-Barré-Syndrom, die reaktive Arthritis und chronische entzündliche Darmerkrankungen wie Morbus Crohn und Colitis ulzerosa sowie das Reizdarmsyndrom, die durch eine initiale Campylobacter-Infektion ausgelöst werden können. Auch kommt es bei immungeschwächten Patienten durch systemische Ausbreitung der Krankheitserreger zu Erkrankungen des Kreislaufsystems und zu Septikämien, die im Einzelfall lebensbedrohlich sein können. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Die Antibiotikatherapie mit Fluorochinolon-Antibiotika und Makroliden ist möglich, wird aber durch mehrere Faktoren erschwert. Zum einen ist der Einsatz dieser Antibiotika bei Durchfallerkrankungen aus pharmakologischen Gründen in vielen Gesundheitssystemen kontraindiziert und zum anderen sind große Teile der Camplyobacter-Populationen weltweit inzwischen resistent gegen diese Chemotherapeutika, die zum Teil auch in der Tierproduktion eingesetzt wurden bzw. regional noch werden. Da die Campylobacter-Bakterien kein Exotoxin produzieren, das die Symptomatik ursächlich auslöst, kommt der Hemmung der Aktivierung des angeborenen Immunsystems in Form von Granulozyten und Makrophagen durch bakterielle Endotoxine wie durch das Lipo-Oligosaccharid bei der Pathogenese eine grundlegende Bedeutung zu. Innovative neue Therapien setzen auf die Kombination von immunmodulierenden und antibakteriellen Wirkstoffen. In der Impfstoffentwicklung spielen konservierte Polysaccharidstrukturen der Bakterien eine besondere Rolle, da die Impfung mit Proteinen durch die außergewöhnlich große genetische Variabilität der Campylobacter-Populationen erschwert wird. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Die mit Campylobacter-Infektionen verbundenen sozioökonomischen Kosten werden – in Abhängigkeit von der Überwachung der Erkrankung durch die Gesundheitssysteme - auf mehrere Milliarden Euro oder Dollar jährlich berechnet. Solche Daten liegen für die EU und die USA vor. Um das Infektionsrisiko für nicht infizierte Menschen durch fäkal-orale-Übertragung zu minimieren, arbeiten staatliche Behörden des medizinischen und veterinärmedizinischen öffentlichen Gesundheitssystems auf allen Ebenen der staatlichen Organisation zusammen, um die Umsetzung der im Infektionsschutzgesetz verankerten Meldepflicht für die Campylobacteriose möglichst effektiv umzusetzen. So können schon kleinste Ausbrüche der Erkrankung erkannt - und auf eine ursächliche Infektionsquelle zurückgeführt werden. Die daraufhin veranlassten exekutiven Maßnahmen zielen darauf ab, eine weitere Ausbreitung der Erkrankungen durch Unterbrechung der Infektionsketten unmöglich zu machen. Auf veterinärmedizinischer Seite regelt die Zoonosen-Richtlinie der EU die Überwachung von Campylobacter in Tieren und seit einigen Jahren ist Campylobacter als Prozesshygienekriterium für Lebensmittelunternehmer in der EU-Verordnung zu Mikrobiologischen Kriterien für die Fleischherstellung enthalten. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Da die Campylobacter-Bakterien kein Exotoxin produzieren, das für die Symptomatik verantwortlich gemacht werden kann, kommt der Aktivierung des angeborenen Immunsystems in Form von Granulozyten und Makrophagen durch bakterielle Endotoxine wie das Lipo-Oligosaccharid bei der Pathogenese eine grundlegende Bedeutung zu. Deshalb sind Impfstrategien mit konservierten Polysacchariden und die Kombination von antibakteriellen und immunmodulatorisch wirkenden Chemotherapeutika im Fokus aktueller Forschung. Die Bestrebungen zur Bekämpfung der globalen Campylobacterose werden durch Grundlagenforschung im Bereich der Zellbiologie, der Immunbiologie, der Gastroenterologie und der Epidemiologie ergänzt. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Da eine vollständige Eliminierung der Campylobacter-Kontamination aus den Lebensmittelproduktionsketten derzeit nicht möglich ist, ist derzeit das Ziel, Bekämpfungsmaßnahmen zur Minimierung des Vorkommens von Campylobacter spp. in den Beständen zu etablieren und die quantitative Belastung von Tieren und Lebensmitteln mit Campylobacter zu senken. Hierzu erscheint eine Kombination mehrerer Verfahren auf verschiedenen Stufen der Lebensmittelkette (schwerpunktmäßig im Geflügelsektor) am erfolgversprechendsten. Interventionsmaßnahmen im Primärproduktionsbereich müssen darauf gerichtet sein, den Eintrag von Campylobacter in die Bestände zu verhindern und die quantitative Belastung zu senken (z. B. durch Optimierung der Haltungsbedingungen, Futter- und Wasserzusätze oder Phagenapplikation). Am Schlachthof kann durch technologische Verfahren die fäkale Kontamination von Fleisch mit Campylobacter reduziert werden. Diese Maßnahmen müssen durch Informationen von Produzenten und Verbrauchern begleitet werden. Für die Verbraucher spielt in der Infektionsvermeidung eine gute Küchenhygiene und die Hygiene bei der Verarbeitung von Lebensmitteln eine besondere Rolle. Neue klinische Aspekte und molekulare Konzepte der Erkrankungen beim Menschen, die in Form von neuen Mausinfektionsmodellen bereitgestellt werden, vervollständigen das Portfolio. |
|
Wo liegen zukünftige Herausforderungen? |
|
Da Geflügelfleischprodukte die Hauptquelle für Infektionen beim Menschen darstellen, ist ein „One World - One Health“ -Ansatz mit gemeinsamen Anstrengungen von Gesundheitsbehörden, Human- und Veterinärmedizin, Grundlagenforschung, Landwirtschaft und Politik erforderlich, um die Belastungen der Gesundheitssysteme durch die Campylobacteriose zu verringern. |
Für die fachliche Unterstützung bei der Erstellung des Campylobacter-Steckbriefes danken wir Prof. Dr. Stefan Bereswill (Charité-Universitätsmedizin, Institut für Mikrobiologie und Infektionsimmunologie,) und Prof. Dr. Thomas Alter (Freie Universität Berlin, Institut für Lebensmittelsicherheit und -hygiene).
April 2021 - MRSA
Kolorierte Biofilm-bildende MRSA. Die kugelförmigen Bakterien (blau) siedeln auf Oberflächen (weiß) und bilden dabei durch Ablagerung von extrazellulärem Material (gelb) einen Biofilm. Quelle: C. Schaudinn/Koloration: C. Jahnke/ZBS-4/RKI (Raster-elektronenmikroskopie)
|
Beschreibung |
|
|
|
|
Erstmals entdeckt |
|
|
Die ersten MRSA wurden bereits kurz nach der Einführung von Methicillin als Antibiotikum in England beschrieben (Abbildung 2). Ab den 1980er Jahren sorgte das Auftreten von MRSA in der Humanmedizin für Besorgnis, insbesondere da diese Antibiotika-resistenten Bakterien sich in Krankenhäusern („hospital-associated“ MRSA, ha-MRSA) verbreiteten und zu einer Vielzahl von schweren Infektionen und Todesfällen führten. Während um 1990 in Deutschland noch >95% der S. aureus Bakterien, die Infektionen bei Menschen verursachten, empfindlich für Methicillin waren, stieg der Anteil der unempfindlichen Bakterien bis 2005 auf ca. 25% an. Vorranging geschah die Verbreitung einzelner MRSA-Klone in Krankenhäusern und Pflegeeinrichtungen; MRSA-Infektionen in der Allgemeinbevölkerung blieben in Deutschland selten („community-assocciated“ (ca) MRSA). Durch die Einführung und konsequente Umsetzung besonderer Hygienemaßnahmen nahm dieser Anteil im letzten Jahrzehnt stetig ab und liegt in Deutschland aktuell bei <10%. Um Infektionen durch MRSA auch dauerhaft weiter senken zu können, müssen die präventiven Maßnahmen weiter fortgesetzt und intensiviert werden.
Abb. 2: Einführung von Antibiotika für die Behandlung von Erkrankungen durch S. aureus, Nachweis von Resistenzen und Ausbreitung bei Menschen und Tieren. In den 1990er Jahren gab es erste Publikationen zu MRSA bei Tieren, zunächst bei Haustieren wie Pferden und Hunden. Ab Mitte der 2000er Jahre traten MRSA auch bei Nutztieren auf, insbesondere bei Schweinen, die besonderen klonalen Linien zugehörig sind („livestock-associated (la)). Von medizinischer Bedeutung war, dass diese Tier-assoziierten MRSA-Stämme auf Personen mit beruflichem Kontakt zum Nutzvieh und deren Angehörige übertragen werden konnten. Hiervon ausgehend wurden diese MRSA vornehmlich in Gebieten mit hoher Schweinehaltung in die regionalen Krankenhäuser eingetragen. Zahlreiche weitere Studien zeigten dann das weltweite Auftreten dieser und anderer MRSA bei Nutztieren (Rinder, Schweine und Geflügel), bei Landwirten und später auch auf Fleisch. Parallel dazu gab es in klinischen Einrichtungen für Kleintiere und Pferde immer wieder MRSA-Ausbrüche. In einer deutschlandweiten Studie, die 2014 publiziert wurde, waren mehr als 50% der in Wundabstrichen von Hunden, Katzen und Pferden nachgewiesenen S. aureus MRSA. Analog zur Epidemiologie in der Humanmedizin sind hier die nasale Kolonisation der Tierärzte und Mitarbeiter, die Aufnahme von bereits mit MRSA kolonisierten oder infizierten Tieren sowie hygienische Mängel entscheidende Einflussgrößen auf die lokale Situation. |
|
|
Wo kommt der Erreger vor? |
|
|
MRSA werden bei Menschen und Tieren (vorwiegend Nutz- und Begleittiere, seltener Wildtiere) sowie auf den von ihnen kontaminierten Oberflächen nachgewiesen. Das European Centre for Disease Prevention and Control (ECDC) schätzte, dass im Jahr 2015 mehr als 148.000 Menschen in der EU eine MRSA-Infektion erlitten haben, an der mehr als 7.000 Menschen gestorben sind. Insgesamt ist der Nachweis einer durch MRSA verursachten invasiven Infektion in Süd- und Südost-Europa um ein Vielfaches häufiger als beispielsweise in skandinavischen Ländern und den Niederlanden. Während in Deutschland der Anteil MRSA an allen S. aureus aus Blutkulturen von 20,8% im Jahr 2010 auf 7,6% im Jahr 2018 gesunken ist (EARS-Net), zeigen andere Europäische Länder wie Italien oder Griechenland diesen Trend nicht. Von allen schweren MRSA-Blutstrominfektionen waren 2018 3% solche, die durch typische la-MRSA verursacht werden (RKI). Dieser Anteil lag in den Nutztierhaltungsregionen in NRW und Niedersachsen bei >10%. |
|
|
Betroffene Tierspezies, Reservoir |
|
|
Betroffen sind vor allem der Mensch als Hauptwirt sowie Säugetiere mit Menschenkontakt. Als Reservoir für MRSA gelten vor allem besiedelte Menschen in Krankenhäusern und Tiere in Tierkliniken sowie die Massentierhaltung und Fleischproduktion. |
|
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
|
Eine alleinige Besiedlung, beispielsweise der Nase, mit MRSA, ist keine Erkrankung. Eine Besiedlung kann jedoch das Risiko für eine Infektionskrankheit durch MRSA erhöhen. Als Risikofaktoren für eine solche Besiedlung gelten frühere Aufenthalte in Krankenhäusern (bei Tieren analog) und die vorherige Gabe von Antibiotika, vor allem für Menschen auch weitere Faktoren, wie Multimorbidität, das Vorhandensein chronischer Wunden, Diabetes mellitus, Dialysepflichtigkeit und Aufenthalt in Pflegeeinrichtungen. Menschen mit Kontakt zu Nutztieren wie Schweine, Rinder oder auch Geflügel wie Tierärzte oder Landwirte sind häufiger mit MRSA besiedelt als die allgemeine Bevölkerung. |
|
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
|
MRSA können alle S. aureus-typischen Infektionen verursachen. Am häufigsten treten bei Menschen und Tieren eitrige Haut- und Weichgewebeinfektionen auf, z.B. Abszesse, die durch chirurgische Maßnahmen (Spaltung) und Antibiotika behandelt werden können. Besonders schwere Infektionen entstehen, wenn MRSA die Haut- und Schleimhautbarrieren überwinden und in das Gewebe und/oder die Blutbahn gelangen. Dann infizieren sie z.B. die Herzklappen, das Lungengewebe oder Knochen und Gelenke, führen dort zu eitrigen Entzündungen und nachfolgend zu Zerstörungen von Geweben und Organen sowie zur Sepsis. Über Blut- und Lymphgefäße oder entlang von anatomischen Strukturen kann es zu weiteren Absiedlungen und Abszessen in den verschiedensten Organen (z.B. Hirnabszesse) kommen. Tückisch sind diese Infektionen auch, weil S. aureus einschließlich MRSA besonders gut darin sind, sich an natürliche und künstliche (z.B. Katheter, künstliche Gelenke) Oberflächen anzuheften und sogenannte Biofilme zu bilden, die durch Antibiotika nur schwer oder nicht therapierbar sind. |
|
|
Gibt es Medikamente oder einen Impfstoff? |
|
|
Hier muss unterschieden werden, ob eine MRSA-Kolonisation i.d.R. im Vorfeld einer geplanten Operation versucht werden soll zu beseitigen oder ob eine MRSA-Infektion therapiert werden muss. Zur Senkung des Infektionsrisikos ist der Versuch der Beseitigung einer MRSA-Besiedlung der Nase angezeigt. Zusätzlich zur Anwendung desinfizierender Seifen oder Lösungen wird sehr häufig ein spezielles Antibiotikum, Mupirocin, verwendet, das als Nasensalbe appliziert wird. Wenn Patienten eine MRSA-bedingte Infektionskrankheit erleiden, gibt es derzeit noch eine Anzahl verschiedener Antibiotika, die trotz der Multiresistenz vieler MRSA wirksam sein können (z.B. Vancomycin, Linezolid, Daptomycin). Zu bedenken ist jedoch, dass diese Antibiotika z.T. klinisch weniger wirksam sein können, weil sie sich z.B. nicht so gut im infizierten Gewebe (Knochen, Lungengewebe) verteilen können oder andere ungünstige Eigenschaften haben. Schwierig wird es, wenn Tiere mit MRSA kolonisiert oder infiziert sind. Da viele Wirkstoffe keine Zulassung für die Anwendung beim Tier haben, ist es für Tierärzte oft schwer, Infektionen wirksam zu therapieren. Auch die Dekolonisierung von Tieren ist nicht trivial. Impfstoffe gegen S. aureus bzw. MRSA sind nicht verfügbar; bisherige Entwicklungen waren nicht erfolgreich. |
|
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
|
MRSA-Screeningprogramme, oft im Rahmen regionaler Netzwerke, gehören zusammen mit anderen Maßnahmen heute zum unerlässlichen Repertoire einer guten Infektionsvorbeugung an human- und veterinärmedizinischen Einrichtungen. In Deutschland müssen Infektionen im Krankenhaus durch MRSA nach §23 des Infektionsschutzgesetzes (IfSG) erfasst werden. Daten des Nationalen Surveillancesystems MRSA-KISS zeigen, dass 2019 etwa 6 von 1.000 im Krankenhaus behandelte Patienten MRSA-Träger waren. Zudem gibt es eine Meldepflicht für MRSA aus Blutkulturen nach §7 IfSG, wodurch 2020 1.126 Nachweise (RKI SurvStat) dokumentiert wurden. Mit ARS, der Antibiotika-Resistenz-Surveillance in Deutschland - wurde die Infrastruktur für eine flächendeckende Surveillance der Antibiotika-Resistenz insgesamt etabliert, die sowohl die stationäre Krankenversorgung als auch den Sektor der ambulanten Versorgung abdeckt, so dass belastbare Daten zur Epidemiologie der Antibiotika-Resistenz in Deutschland bereitgestellt werden. Auf Basis dieser verlässlichen und repräsentativen Daten können gezielt Maßnahmen zur Begrenzung des Problems ergriffen werden. Das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) erhebt jährlich Resistenzdaten zu Infektionserregern von Lebensmittel liefernden Tieren und Heimtieren (Resistenzmonitoring GERM-Vet). Hierbei wird auch das Auftreten von MRSA bei den unterschiedlichen Tierarten erfasst. Im Rahmen des Zoonosenmonitorings werden repräsentative Proben aus der Lebensmittelkette (Erzeugerbetrieben, Schlachthöfen, Einzelhandel) und aus der „freien Wildbahn“ auf MRSA untersucht. Das Nationales Referenzlabor für koagulasepositive Staphylokokkeneinschließlich Staphylococcus aureus am Bundesinstitut für Risikobewertung (BfR) ist zuständig für Fragen zur Lebensmittelsicherheit und Lebensmittelhygiene im Hinblick auf MRSA in Lebensmitteln. Das Referenzlabor für MRSA in der Humanmedizin ist das Nationale Referenzzentrum (NRZ) für Staphylokokken und Enterokokken am Robert Koch-Institut. Für infektionsmedizinische Probleme durch MRSA bei Haustieren oder in Tierkliniken gibt es das Konsiliarlabor der Deutschen Veterinärmedizinischen Gesellschaft (DVG) für Methicillin-resistente Staphylokokken an der Freien Universität Berlin (Institut für Mikrobiologie und Tierseuchen). |
|
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
Die Forschung zum Thema zoonotische MRSA verfolgt einen transsektorialen und interdisziplinären Ansatz: Aufgrund der erforderlichen engen Kooperation zwischen Wissenschaftler*innen aus der Human- und Veterinärmedizin sowie den Agrar- und Umweltwissenschaften ist hier der „One Health“- Gedanke zunehmend Richtschnur, denn Antibiotikaresistenzen kennen keine menschengemachten organisatorischen und fachlichen Grenzen (Abbildung 2, 3). |
|
|
Welche Bekämpfungsstrategien gibt es? |
|
|
Für die Bekämpfung zoonotischer MRSA gibt es grundsätzlich zwei sich ergänzende Hauptaspekte, a) die Verringerung der MRSA-Last bei Haus- und Nutztieren sowie b) die Verhinderung der Übertragung von MRSA zwischen Menschen und Tieren in beide Richtungen (Abbildung 3).
Abb. 3: Aktuelle Forschung auf dem Gebiet „Interventionen gegen zoonotische MRSA“ |
|
|
Wo liegen zukünftige Herausforderungen? |
|
|
Die Herausforderungen für die zukünftige Forschung sind, analog zur Komplexität der beteiligten Faktoren (Human- und Tiermedizin, Landwirtschaft und Umwelt), sehr vielfältig: Eine Beteiligung aller betroffenen Gebiete sowie länderübergreifender Kooperationen zur Verringerung der weiteren weltweiten Akkumulation von Antibiotikaresistenzen angesichts der wenigen neuen (oral applizierbaren) Wirkstoffe zur Behandlung von Infektionskrankheiten ist notwendig. Die Forschungen betreffen MRSA, aber auch andere multiresistente Erreger (MRE). Wichtige Stichpunkte sind:
|
|
|
Sonstiges |
|
|
Weiterführende Informationen Forschungsverbund #1HealthPREVENT und aktuelle Publikationen des Verbundes Nationale Referenzzentrum (NRZ) für Staphylokokken und Enterokokken am Robert Koch-Institut Nationales Referenzzentrum für Surveillance von nosokomialen Infektionen (MRSA-KISS) Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) Antibiotika-Resistenz-Surveillance in Deutschland (ARS) Bundesinstitut für Risikobewertung (BFR): Fragen und Antworten für Tierärzte zu MRSA Bundeszentrale für gesundheitliche Aufklärung (BZgA): Informationen zu MRSA Nationale Kampagne zur Verbesserung der Compliance der Händedesinfektion in deutschen Gesundheitseinrichtungen (Aktion saubere Hände) Informationsseite der World Health Organization (WHO) zu antimikrobieller Resistenz Informationen und Guidelines zur Prävention und Kontrolle von MRSA (Robert Koch-Institut) Nationales Referenzlabor für koagulasepositive Staphylokokken einschließlich Staphylococcus aureus (NRL-Staph) |
Für die Erstellung des Steckbriefes danken wir Dr. Birgit Walther (Robert Koch-Institut), Dr. Antina Lübke-Becker (Freie Universität Berlin), Dr. Christiane Cuny (Robert Koch-Institut), Prof. Dr. Karsten Becker (Universitätsmedizin Greifswald, Friedrich Loeffler-Institut) und Dr. Robin Köck (Universitätsklinikum Münster, DRK Kliniken Berlin).
März 2021 - Brucella spp.
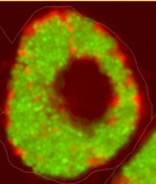
Fluoreszenzmikroskopisches Bild intramakrophagischer Brucella suis (GFP markiert). Brucella-enthaltende Vakuolen füllen das Zytosol der Wirtszelle nahezu vollständig aus. (Bild: Stephan Köhler, Institut de Recherche en Infectiologie à Montpellier (IRIM), CNRS, INSERM, Frankreich)
|
Beschreibung |
|
Brucella spp. gehören zu den Alphaproteobacteria und sind damit nah verwandt mit Tier- und Pflanzenpathogenen, wie Bartonella spp. und Agrobacterium tumefaciens, sowie Umweltkeimen, wie beispielsweise Ochrobactrum spp. Innerhalb des Genus werden aktuell zwölf Spezies beschrieben, welche sich in ihrer Pathogenität und ihrem tierischen Hauptwirt unterscheiden (siehe betroffene Tierspezies). Es handelt sich um fakultativ intrazelluläre, gramnegative, kokkoide Stäbchenbakterien. Die Unterscheidung der einzelnen Spezies und einiger Biovare beruht auf einer Reihe klassischer mikrobiologischer Tests (CO2-Bedarf, H2S-Bildung, Ureaseaktivität, Wachstumshemmung durch die Farbstoffe Thionin und Fuchsin, Agglutinationstests mit monospezifischen Antikörpern, Phagenlyse). Brucellen galten bislang als obligat aerob und unbeweglich. Sie sind aber in der Lage, ihren Stoffwechsel unter Sauerstoffmangel auf Nitratatmung umzustellen. Neuere atypische Brucella-Spezies, welche aus wechselwarmen Tieren isoliert wurden, besitzen außerdem ein Flagellum, welches ihnen die Fortbewegung ermöglicht. Sie gelten als Vorgänger der klassischen humanpathogenen Spezies. Ein Lipopolysaccharid an der Zelloberfläche ermöglicht Brucellen das Eindringen in Zellen des Monozyten-Makrophagen-Systems des Wirts und verhindert die Verschmelzung des Phagosoms mit dem Lysosom. Das saure Milieu innerhalb des Phagosoms aktiviert einen VirB Typ IV-Sekretionsapparat des Bakteriums, über den Effektorproteine in die Zielzelle ausgeschleust werden, welche die Assoziation der Brucella-enthaltenden Vakuole mit dem endoplasmatischen Retikulum vermitteln und den Umbau zu einer erregerspezifischen replikativen Nische fördern. Die Infektion des Makrophagen verhindert dessen Apoptose, so dass das Pathogen sein eigenes intrazelluläres Überleben sichert und sich ungestört in der Zielzelle vermehren kann. Einige Brucella Spezies werden der Risikogruppe 3 zugeordnet. Brucella suis wurde in den 1950er Jahren erstmals als biologischer Kampfstoff in den Vereinigten Staaten aufmunitioniert. Brucella zählt zur Kategorie B der bioterroristisch relevanten Agenzien mit mittlerer Letalitätsrate, ist sehr umweltstabil, hoch infektiös und lässt sich leicht als Aerosol ausbringen. Andererseits kann die Verbreitung des Erregers aber auch gut eingedämmt werden und die humane Brucellose ist behandelbar. |
|
Erstmals entdeckt |
|
Der Erreger wurde erstmals im Jahr 1887 von Dr. David Bruce, einem Militärarzt, aus der Milz eines verstorbenen Soldaten des britischen Empire isoliert und als Micrococcus melitensis beschrieben. Bruce war im Dienst der britischen Krone auf Malta und diagnostizierte bei zahlreichen, der dort stationierten Soldaten, ein unklares Fieber. Die Krankheit, welche damals auch als Mittelmeer- oder Maltafieber bekannt war, führte bei den erkrankten Soldaten zu langanhaltender Dienstunfähigkeit und ca. 10 % der Infizierten verstarben. Knapp ein Jahrzehnt nach der Erstbeschreibung des Bakteriums gelang es dem Malteser Arzt Dr. Themistocles (aliasTemi) Zammit im Jahr 1905, den Übertragungsweg der Brucellose aufzuklären. Er isolierte den Erreger aus Ziegenmilch, welche üblicherweise direkt nach dem Melken als noch euterwarme Rohmilch verzehrt wurde. Ein angeordnetes Konsumverbot führte letztlich zu einem Rückgang der Krankheitszahlen bei den auf Malta stationierten britische Soldaten. |
|
Wo kommt der Erreger vor? |
|
Brucella spp. sind weltweit verbreitet. Etwa 500.000 Humaninfektionen werden jährlich gemeldet; die Dunkelziffer wird zwanzigmal höher angenommen. Infektionen mit Brucella melitensis und abortus werden gehäuft aus dem Mittelmeerraum, der Balkanregion, dem Mittleren Osten, Asien, Afrika, Mittel- und Südamerika berichtet. In Deutschland, Nordeuropa und Nordamerika wurde die Schaf-/Ziegen- und Rinderbrucellose erfolgreich aus den Nutztierbeständen eradiziert. Es gibt zahlreiche Länder und Regionen, in denen scheinbar nur eine geringe Prävalenz der Brucellose in den Nutztierbeständen vorliegt. Allerdings sind nicht überall hinreichend gute Überwachungs- und Kontrollsysteme für Zoonosen etabliert. Auch in eigentlich brucellosefreien Gebieten kann es sporadisch zu Ausbrüchen infolge eines Überspringens des Erregers aus der Wildtierpopulation kommen. In Deutschland beispielsweise sind immer wieder Schweinezucht- und Mastbetriebe mit Freilandtierhaltung betroffen. Die Hausschweine infizieren sich bei Wildschweinen mit B. suis bv 2, ein Biovar von geringer Humanpathogenität. |
|
Betroffene Tierspezies, Reservoir |
|
Mehr als ein Jahrhundert lang galten lediglich Säugetiere als mögliche Wirte der Brucella spp. Die verschiedenen Spezies zeigen eine ausgesprochene Wirtspräferenz. Brucella melitensis (bv 1-3) infiziert überwiegend Schafe, Ziegen und Kamele, B. abortus (bv 1-7, 9) Rinder und Büffel, B. suis in Abhängigkeit vom Biovar Schweine (bv 1-3), Rentiere (bv 4) und Nagetiere (bv 5), B. canis Hunde, B. ovis Schafe und B. neotomae die Wüstenbuschratte. Von diesen sechs klassischen Spezies gelten die drei Erstgenannten als besonders humanpathogen, während B. canisseltener zur Infektion des Menschen führt und B. neotomae nur in Einzelfällen. Aus Meeressäugetieren wurden B. ceti (Wale, Tümmler und Delfine) und B. pinnipedialis (Seehunde, Seelöwen, Walrösser) isoliert. Ausschließlich der Sequenztyp ST27 bei B. ceti gilt unter den marinen Brucellae als humanpathogen. Die neuen und teilweise atypischen Brucella spp. umfassen B. microti (in Feldmäusen vorkommend), B. vulpis (in Füchsen) und B. papionis (in Pavianen). Brucella inopinata und ähnliche Stämme wurden anfangs im Zusammenhang mit opportunistischen Infektionen beim Menschen beschrieben. Zunehmend kommt es zum Nachweis dieses Erregers und B. microti-ähnlicher Stämme bei Amphibien, z.B. bei Afrikanischen Ochsenfröschen, Laub- und Seefröschen. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Menschen infizieren sich meist infolge des Verzehrs kontaminierter tierischer Lebensmittel. Rohmilch und nicht-pasteurisierte Milchprodukte, wie Rohmilchkäse, aber auch rohes Fleisch können zur Infektion führen. In endemischen Gebieten mit hoher Prävalenz der Brucellose in den Nutztierbeständen treten auch zahlreiche Fälle durch direkten Kontakt mit infizierten Tieren bzw. mit hochkontagiösem Abortmaterial auf. Dieser Übertragungsweg findet sich in der Regel bei Berufsgruppen, welche vermehrt Tierkontakte haben oder tierische Produkte verarbeiten, z.B. bei Veterinären*Innen oder Schlachthofpersonal. In brucellosefreien Ländern sind die meisten Fälle auf Reisen in Endemiegebiete oder Migration aus denselben zurückzuführen. In Deutschland sind überwiegend Menschen mit türkischem Migrationshintergrund betroffen. Außerdem ist die Brucellose die häufigste bakterielle Laborinfektion weltweit, da einzelne Bakterien ausreichen, um nach einer Inhalation zum vollen Krankheitsbild zu führen. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Die Brucellose vermindert bei Haus- und Nutztieren die Reproduktionsrate infolge eingeschränkter Fertilität (ursächlich sind Orchitis und Epididymitis bzw. Endometritis) und durch Spätaborte, Frühgeburten oder die Geburt lebensschwacher Tiere. Häufig verläuft die Infektion aber auch latent, vor allem bei Wildtieren. Beim Menschen präsentiert sich die akute Brucellose als fieberhafter, grippeähnlicher Infekt mit Kopf- und Gliederschmerzen, Abgeschlagenheit und Müdigkeit. Leber, Milz und Lymphknoten sind teilweise vergrößert. Die Fieberkurve kann charakteristischerweise wellenförmig verlaufen mit ansteigender Körpertemperatur über den Tag und einer starken Entfieberung mit ausgeprägter Schweißneigung und Schüttelfrost im Verlauf der Nacht (daher rührt auch die frühere Bezeichnung undulierendes Fieber). Etwa 10-15 % der Patienten entwickeln trotz adäquater antibiotischer Therapie nach sechs Wochen eine chronische Verlaufsform mit sehr unterschiedlichen klinischen Manifestationen. Am häufigsten treten Entzündungen im Bereich des Achsenskeletts (Spondylitis, Sakroiliitis) auf, aber auch periphere Gelenke können betroffen sein. Verantwortlich für tödliche Verläufe (ca. 2 % aller Fälle) sind Meningoenzephalitis und Endokarditis. Die Klinik der chronischen Brucellose ist sehr variabel und die Infektion kann nahezu jedes Organsystem befallen. In betroffenen Geweben kommt es zu einer granulomatösen, nicht-verkäsenden Entzündungsreaktion, selten mit Abszessbildung. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Für Nutztiere stehen Impfstoffe zur Verfügung. Zum einen der B. melitensis-Stamm Rev 1 für Schafe und Ziegen und zum anderen die beiden B. abortus-Stämme S19 und RB51 für Rinder. Es handelt sich um attenuierte Lebendimpfstoffe, welche allerdings nach der Impfung ebenfalls zu Aborten führen können und beim Menschen das Vollbild der Erkrankung auslösen. Insbesondere der Einsatz von RB51 wird in diesem Zusammenhang kritisch diskutiert. Ein geimpftes Tier lässt sich aufgrund einer anderen LPS-Struktur (rough LPS) beim RB51-Impfstamm leicht serologisch von einem mit einem Wildstamm (smooth LPS) infizierten Tier unterscheiden, was ein Vorteil in der Überwachung darstellt. Andererseits besitzt der Impfstamm eine Antibiotikaresistenz gegenüber Rifampicin, welches als Mittel der ersten Wahl in der antibiotischen Therapie der humanen Brucellose eingesetzt wird. Nur in Regionen mit einer sehr hohen Prävalenz der Brucellose in Nutztierbeständen macht die Impfung der Tiere letztlich Sinn, um die Verbreitung des Erregers einzudämmen. Impfstoffe für die Anwendung beim Menschen (beispielsweise für stark exponierte Berufsgruppen) gib es nicht, da Totimpfstoffe oder Bakterienbestandteile keine ausreichend hohe Immunität hervorrufen. Die Postexpositionsprophylaxe entspricht quasi der antibiotischen Therapie einer akuten Brucellose. Für die Behandlung der Brucellose kommen verschiedene Antibiotika zum Einsatz, welche in unterschiedlicher Kombination verabreicht werden. Als First-Line-Therapie wird Rifampicin kombiniert mit Doxycyclin empfohlen. Alternativ kann auch ein Aminoglykosid (Streptomycin, Gentamicin) zusammen mit Doxycyclin verabreicht werden. Das letztgenannte Schema kommt häufiger in Endemiegebieten zum Einsatz, da die Zahl der primären Therapieversager und Rezidive geringer ausfällt als bei der Anwendung von Rifampicin. Im Gegenzug werden potenziell schwerwiegende Nebenwirkungen der Aminoglykoside (Ototoxizität, Nephrotoxizität) in Kauf genommen. Cotrimoxazol (Trimethoprim und Sulfamethoxazol) wird bei Schwangeren als Monotherapie verabreicht und ersetzt bei Kindern bis zum achten Lebensjahr das Doxycyclin (CAVE: Zahnschmelzdefekte und verzögertes Knochenwachstum). Antibiogramme sind für die Therapie der humanen Brucellose nicht wegweisend. Beispielsweise sind Brucella spp. in der in vitro-Testung meist empfindlich gegenüber Ciprofloxacin; das Fluorochinolon wirkt aber nicht im sauren Milieu der intramakrophagischen Brucella-enthaltenden Vakuolen. Die Dauer der Antibiotikatherapie sollte sechs Wochen nicht unterschreiten und muss bei der chronischen Brucellose mit Organmanifestationen in Abhängigkeit vom Behandlungserfolg meist deutlich verlängert werden. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Nach Infektionsschutzgesetz (gemäß § 7 Abs. 1 IfSG) ist der direkte oder indirekte Nachweis von Brucella spp. in Deutschland namentlich meldepflichtig, sofern dieser auf eine akute Infektion beim Menschen hinweist. Die Brucellose der Rinder, Hausschweine, Schafe und Ziegen ist eine anzeigenpflichtige Tierseuche (gemäß § 1 der Verordnung über anzeigepflichtige Tierseuchen). Die Überwachung in den Tierbeständen ist in der Verordnung zum Schutz gegen die Brucellose der Rinder, Schweine, Schafe und Ziegen (Brucellose-Verordnung) geregelt. Sowohl vor dem Import von Nutztieren aus Drittstaaten als auch bei der innergemeinschaftlichen Verbringung innerhalb der Europäischen Union muss zuvor die Brucellosefreiheit des Bestandes garantiert werden. Ein Überwachungssystem für die Brucellose bei Wildtieren existiert nicht. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Schwerpunkte in der aktuellen Forschung zur Brucellose sind:
|
|
Welche Bekämpfungsstrategien gibt es? |
|
In Endemiegebieten kann mit Hilfe von Impfprogrammen bei Rindern, Schafen und Ziegen die Ausscheidung des Erregers und damit die Durchseuchung der Nutztierbestände vermindert werden. Da die Impfung keinen absoluten Schutz darstellt und die Impfstämme selbst infektiös für Tier und Mensch sind, müssen sich effektive Überwachungs- und Kontrollmaßnahmen anschließen. Durch regelmäßige serologische Testungen (Blut oder Tankmilch) oder Verdachtsuntersuchungen bei entsprechenden klinischen Befunden (gehäufte Aborte) werden von der Brucellose betroffene Bestände identifiziert. Positiv getestete Tiere werden vom Bestand abgesondert und infizierte Tiere gekeult. Innerhalb der Europäischen Union erhält der betroffene Tierhalter eine finanzielle Entschädigung. Da diese Strategie in ärmeren Ländern nicht durchzusetzen ist, müssen dort die Verbraucher durch adäquate Maßnahmen der Lebensmittelhygiene geschützt werden. Brucella lässt sich zuverlässig mittels Erhitzens kontaminierter Lebensmittel abtöten und allein das Pasteurisieren von Milch verhindert schon die meisten Infektionen. In Endemiegebieten sind außerdem Arbeitsschutz- und Hygienemaßnahmen im Umgang mit potenziell infizierten Tieren einzuhalten. Dies gilt insbesondere für Berufsgruppen, die in direktem Kontakt mit infizierten Tieren stehen (z.B. im Rahmen der Geburtshilfe) oder tierische Produkte zu Lebensmitteln prozessieren (z.B. in Schlachtbetrieben). |
|
Wo liegen zukünftige Herausforderungen? |
|
Infolge der globalen Warenketten im Tier- und Lebensmittelhandel ist der Wiedereintrag von Brucella spp. in brucellosefreie Nutztierbestände eine der größten Herausforderungen in der weltweiten Kontrolle dieser Zoonose. Auch der Übertrag aus der Wildtierpopulation spielt aufgrund der von Verbrauchern*Innen zunehmend gewünschten artgerechteren Freilandtierhaltung in Industrienationen eine immer größere Rolle. In Endemiegebieten hingegen müssen verbesserte tierärztliche Überwachungs- und Kontrollmaßnahmen etabliert werden. Diese versagen vor allem in Konfliktregionen oder aus Ressourcenmangel. Die Verbraucheraufklärung in ärmeren und ländlichen Regionen müsste deutlich optimiert werden und sollte vor allem das gesundheitliche Risiko beim Verzehr traditioneller Rohprodukte im Fokus haben. Durch vermehrte Migrationsbewegungen und den weltweiten Tourismus werden zukünftig auch viele Brucellose-Patienten in Nicht-Endemiegebieten auftreten. In einer epidemiologischen Studie aus Deutschland konnte belegt werden, dass gerade diese Fälle nur sehr verzögert diagnostiziert und therapiert werden, was chronische und letale Verläufe wahrscheinlicher macht. Deshalb sollte der Brucellose, wie auch anderen derzeit nur wenig beachteten Zoonosen, im Ausbildungscurriculum klinisch tätiger Ärzte mehr Aufmerksamkeit geschenkt werden. |
|
Sonstiges |
|
World Health Organisation (WHO): https://www.who.int/news-room/fact-sheets/detail/brucellosis Centers for Disease Control and Prevention (CDC): https://www.cdc.gov/brucellosis/ Robert Koch-Institut (RKI): https://www.rki.de/DE/Content/InfAZ/B/Brucellose/Brucellose Friedrich-Loeffler-Institut (FLI): https://www.fli.de/de/institute/institut-fuer-bakterielle-infektionen-und-zoonosen-ibiz/referenzlabore/oie-und-nrl-fuer-brucellose/ One Health European Joint Programme - Identification of emerging Brucella species (IDEMBRU): new threats for humans and animals: https://onehealthejp.eu/jrp-idembru/ |
Für die fachliche Unterstützung bei der Erstellung des Brucella spp. Steckbriefes danken wir Prof. Dr. Sascha Al Dahouk (Bundesinstitut für Risikobewertung).
Februar 2021 - Hantaviren
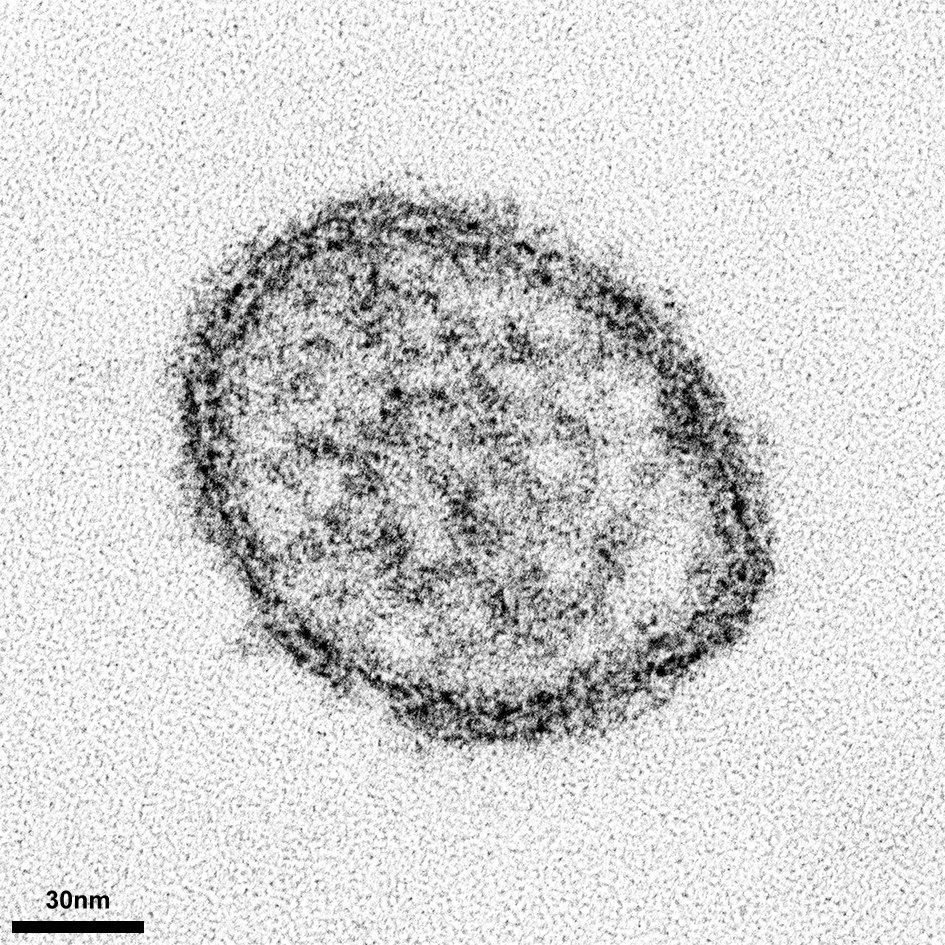
Elektronenmikroskopische Aufnahme eines Hantavirus-Partikels (Copyright Bild: Dr. Kati Franzke, Labor für Elektronenmikroskopie, FLI)
|
Beschreibung |
|
Hantaviren sind behüllte Viren mit einem segmentierten RNA-Genom negativer Polarität. Ordnung Bunyavirales, Familie Hantaviridae, mit 4 Gattungen; die Gattung Orthohantavirus bein-haltet die bisher als humanpathogen bekannten Hantaviren. Die Benennung der Hantaviren erfolgt anhand des Ortes der Erstbeschreibung. |
|
Erstmals entdeckt |
|
Langjährige Untersuchungen nach dem Koreakrieg mit mehreren tausend erkrankten Soldaten führten 1978 zur Entdeckung des Hantaan-Orthohantavirus. Bereits in den 1960er Jahren war das Thottapalayamvirus entdeckt und als Arbovirus klassifiziert worden, das aber erst in den 1990er Jahren nach intensiver genetischer Charakterisierung als Hantavirus identifiziert wurde. |
|
Wo kommt der Erreger vor? |
|
Hantaviren kommen wahrscheinlich weltweit vor; die Datenlage für Australien ist sehr schwach. Das Vorkommen der Erreger ist an das Verbreitungsgebiet der Reservoire gebunden. In Amerika kommen Hantaviren vor, die das Hantavirale Cardiopulmonale Syndrom (HCPS) verursachen mit einer Letalitätsrate von bis zu 40%. In Europa, Asien und Afrika kommen Hantaviren vor, die das Hämorrhagische Fieber mit Renalem Syndrom (HFRS) mit einer Letalitätsrate von bis zu 10% hervorrufen. Das mit Wanderratten und anderen Rattenarten assoziierte Seoul-Orthohantavirus (SEOV), ebenfalls Erreger des HFRS, kommt vermutlich weltweit vor. |
|
Betroffene Tierspezies, Reservoir |
|
Alle bisher als humanpathogen bekannten Hantaviren sind in Nagetieren gefunden worden. Jede Hantavirusart ist in der Regel mit einer Nagetierart assoziiert. Darüber hinaus sind in den vergangenen Jahren weitere Hantaviren in Spitzmäusen, Maulwürfen und Fledermäusen gefunden worden, deren Humanpathogenität unbekannt ist. Außerdem wurden vor kurzem auch Hantaviren bei Fischen und Reptilien entdeckt. Die Reservoirtiere erkranken selber nicht. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Die Hantaviren werden von persistent infizierten Nagetieren mit Urin, Kot und Speichel ausgeschieden. Die Übertragung auf den Menschen erfolgt vorwiegend durch das Inhalieren Virus-kontaminierter Stäube. Ein direkter Kontakt zu den Nagetieren ist für die Übertragung nicht erforderlich. Auch eine Übertragung durch Bisse ist beschrieben worden. Wegen des Expositionsrisikos stellen z.B. Waldarbeiter, Schädlingsbekämpfer und Soldaten besonders gefährdete Risikogruppen dar. Der Umgang mit gelagertem Brennholz, das Reinigen von Schuppen und anderen Räumen oder bestimmte Tätigkeiten im Freien, insbesondere in Jahren mit einer erhöhten Zahl infizierter Nagetiere, können zu einer Gefährdung der Allgemeinbevölkerung führen. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Der Schweregrad des HFRS-Verlaufs hängt unter anderem von der Art des Hantavirus ab. In Deutschland vorkommende Hantavirus-Arten können grippeähnliche Infektionen mit über drei bis vier Tage anhaltendem hohen Fieber sowie Kopf-, Bauch- und Rückenschmerzen verursachen. In einer darauffolgenden Krankheitsphase können Blutdruckabfall und schließlich Nierenfunktions-störungen bis zum akuten Nierenversagen auftreten. Sehr selten kann sich die Erkrankung auf die Lunge auswirken oder deutlich sichtbare, äußere Blutungen verursachen. Ein großer Teil der Infektionen beim Menschen verläuft jedoch ganz ohne oder mit milden und unspezifischen Symptomen („Sommergrippe“). Bei verschiedenen Nichtreservoirtieren sind Hantavirus-reaktive Antikörper gefunden worden; über Erkrankungen von diesen Tieren ist nichts bekannt. Die Leptospirose stellt eine Erkrankung mit zum Teil ähnlichen Symptomen dar, die auch von Nagetieren auf den Menschen übertragen wird und bei der Differenzialdiagnostik in Betracht gezogen werden sollte. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Bisher existieren in Europa keine zugelassenen Impfstoffe. Die Therapie erfolgt vor allem sympto-matisch. Zum Teil werden Medikamente mit breitem antiviralen Spektrum eingesetzt. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Der Labornachweis von Hantaviren beim Menschen sowie die Erkrankung an virusbedingtem hämorrhagischen Fieber ist laut Infektionsschutzgesetz in Deutschland meldepflichtig. Durch die Meldepflicht sind Jahre und Gebiete mit erhöhten Hantavirus-Erkrankungszahlen identifiziert worden. Das Puumala-Orthohantavirus (PUUV) verursacht im westlichen, südlichen und nordwestlichen Teil Deutschlands in bestimmten Jahren (Ausbruchsjahre) eine deutlich erhöhte Zahl von Hantavirus-Erkrankungen. Das Dobrava-Belgrad-Orthohantavirus (DOBV) kommt, wegen der Verbreitung der Brandmaus, nur im östlichen Teil Deutschlands vor. Kürzlich wurde in Deutschland eine von einer Heimratte (Wanderratte) übertragene SEOV-Erkrankung beschrieben. Das Robert Koch-Institut stellt aktuelle und historische Erkrankungszahlen in einem Onlinetool bereit (survstat.rki.de). Die gemeinsamen Untersuchungen des Konsiliarlaboratoriums für Hantaviren/Charité, des Julius Kühn-Instituts und des Friedrich-Loeffler-Instituts haben zur Erstellung eines Katasters von Hantavirusvorkommen im Tierreservoir in Deutschland geführt. Diese Untersuchungen führten zur Ermittlung der gegenwärtigen Verbreitung des PUUV und des DOBV, Genotyp Kurkino. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
Welche Bekämpfungsstrategien gibt es? |
|
Die Vermeidung von Hantavirus-Erkrankungen basiert auf der Expositionsprophylaxe. Insbesondere in „Hantavirusjahren“ wird hierauf auch durch den öffentlichen Gesundheitsdienst in Endemie-regionen verstärkt hingewiesen. Ein wichtiger Schwerpunkt ist die Vermeidung des Eindringens von (potenziell Hantavirus-infizierten) Nagetieren in Wohn- und Arbeitsräume. Bei besonders gefährlichen Tätigkeiten ist das Tragen einer Atemschutzmaske zu empfehlen. Weitere Hinweise finden Sie auf dem Merkblatt „Wie vermeide ich Hantavirus-Infektionen?“ |
|
Wo liegen zukünftige Herausforderungen? |
|
Für die fachliche Unterstützung bei der Erstellung des Hantavirus Steckbriefes danken wir Prof. Dr. Rainer G. Ulrich (Friedrich-Loeffler-Institut (FLI)),Dr. Mirko Faber (Robert Koch-Institut), Dr. Jens Jacob (Julius Kühn-Institut), Prof. Dr. Jörg Hofmann (Charité, Berlin), Dr. Johannes Dressman (Niedersächsisches Landesgesundheitsamt, NGLA), Dr. Christiane Klier (NGLA), Kathrin Jeske (FLI) und Dr. Stephan Drewes (FLI).
Januar 2021 - Coxiella burnetii
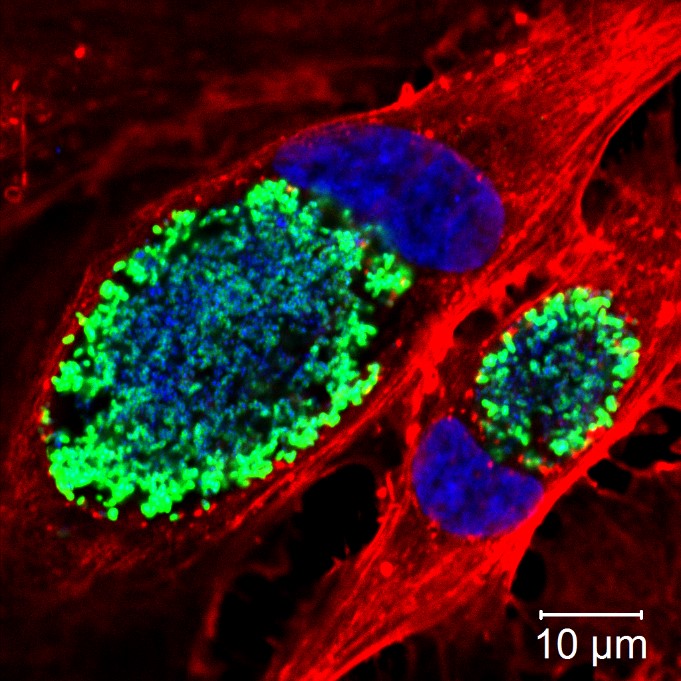
Humane Endothelzellen infiziert mit Coxiella burnetii. Zellen wurden markiert mit Antikörpern gegen C. burnetii (grün), Aktin (rot) und DAPI (blau). DAPI markiert den Zellkern der infizierten Zellen, in denen sich jeweils eine große mit C. burnetii gefüllte Vakuole befindet. Bild: Q-Gaps
|
Beschreibung |
|
Coxiella (C.) burnetii ist ein obligat intrazelluläres Gram-negatives Bakterium (Familie Coxiellaceae, Ordnung Legionellales, Klasse Gammaproteobakterien) und der Erreger des Q-Fiebers. Der Erreger kann in zwei antigenen Formen existieren: Phase I und Phase II. Diese sog. Phasenvarianz basiert auf der Lipopolysaccharidstruktur (LPS) der äußeren Zellmembran. Bakterien mit einem kompletten, langkettigen LPS werden als Phase I bezeichnet und sind virulent. Bakterien der Phase II weisen ein stark verkürztes LPS auf und sind weitgehend avirulent. Coxiellen können Monozyten und Makrophagen invadieren und sich im sauren Milieu des Phagolysosoms vermehren. Zwei Entwicklungsstadien werden morphologisch unterschieden, die „Small-Cell-“Variante (SCV) und die „Large-Cell-“Variante (LCV). Die SCV ist die extrazelluläre, umweltresistente Form, die über Monate in der Umwelt, wie Staub und Heu, persistieren und infektiös bleiben kann, während die LCV als stoffwechselaktive, vermehrungsfähige intrazelluläre Form angesehen wird. Der Erreger wird in die Risikogruppe 3 eingestuft und zählt aufgrund seiner geringen Infektionsdosis, Umweltstabilität und Luftübertragbarkeit zu den potenziellen biologischen Kampfstoffen (Bioterrorismus). |
|
Erstmals entdeckt |
|
Das Q-Fieber wurde als erstes vom australischen Forscher Edward Derrick beschrieben, der die Erkrankung bei Schlachthausarbeiter*innen in Australien beobachtete. (Derrick EH. “Q” fever, a new fever entity: clinical features, diagnosis, and laboratory investigation. Med J Aust. 1937;2: 281–99). Da Derrick die beobachteten Symptome keiner bekannten Krankheit zuordnen konnte, wurde die Erkrankung als Q-Fieber, für „query“- unbestimmt, bezeichnet. C. burnetii wurde später nach dem amerikanischen Bakteriologen Herald Rea Cox und dem australischen Arzt Frank Macfarlane Burnet benannt, die beide unabhängig voneinander das Bakterium in den 1930er Jahren isoliert haben. Burnet FM, Freeman M (1937). "Experimental studies on the virus of "Q" fever". Med J Aust. 2 (4): 299–305; Davis, Gordon E.; Cox, Herald R.; Parker and R. E. Dyer, R. R.; Dyer, R. E. (1938). "A Filter-Passing Infectious Agent Isolated from Ticks". Public Health Reports. Association of Schools of Public Health. 53 (52): 2259–82 |
|
Wo kommt der Erreger vor? |
|
Coxiella burnetii kommt mit Ausnahme von Neuseeland und Antarktis weltweit vor. |
|
Betroffene Tierspezies, Reservoir |
|
Hauswiederkäuer (Schafe, Ziegen und Rinder) scheiden den Erreger besonders während der Geburt oder eines Abortes in großen Mengen mit Geburtsflüssigkeiten und Nachgeburt aus. Zusätzlich erfolgt die Ausscheidung über Milch, Urin und Kot. Besonders bei Schafen kann eine Infektion mit Coxiella burnetii komplett symptomlos verlaufen, sodass ohne eine regelmäßige Probenuntersuchung nicht unbedingt bemerkt wird, ob die Tiere den Erreger ausscheiden. Dennoch sind Fehlgeburten, Totgeburten, Geburten lebensschwacher Neugeborener und der verzögerte Abgang der Nachgeburten als mögliche Anzeichen für Q-Fieber bei Hauswiederkäuern ernst zu nehmen. Auch andere Haus- und Wildsäugetiere (wie z.B. Katzen, Insekten und Spinnentiere können den Erreger ausscheiden, bilden aber nicht das Hauptreservoir für Infektionen beim Menschen. Die Übertragung durch Zecken ist noch nicht eindeutig geklärt. Jedoch dürfte vor allem der Zeckenkot eine wesentliche Rolle bei der Verbreitung von C. burnetii spielen. Infizierte Zecken können große Erregermengen mit dem Kot ausscheiden. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Menschen infizieren sich hauptsächlich durch das Einatmen von bakterienhaltigen Stäuben oder Tröpfchen. Deshalb besteht besonders ein Risiko für Personen, die sich in unmittelbarer Nähe von erregerausscheidenden Hauswiederkäuern (Schafe, Ziegen, Rindern) aufhalten. Zudem werden erregerhaltige Stäube mit dem Wind weit verbreitet, so dass sich auch Menschen ohne Bezug zur Wiederkäuerhaltung mit C. burnetii infizieren können. Darüber hinaus kann der Erreger durch Ausbringen von Mist, der nicht ausreichend durcherhitzt war sowie während der Schafschur freigesetzt werden. Infektionen durch den Verzehr von Rohmilch- und Rohmilchprodukten sind äußerst selten und das Risiko wird als äußerst gering eingestuft (BfR). Personen, die berufsbedingt Kontakt zu Schafen, Ziegen oder Rindern bzw. Materialien dieser Tiere haben, wie beispielsweise Tierhalter*innen, Schäfer*innen, Scherer*innen, Tierärzt*innen und ihre Mitarbeiter*innen, Labormitarbeiter*innen sowie Schlachthofarbeiter*innen, haben ein erhöhtes Risiko für eine Coxiella burnetii-Infektion. |
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Akutes Q-Fieber beim Menschen: Nach einer Inkubationszeit von 1-3 Wochen zeigen ca. 40 % der Infizierten klinische Symptome, während bei den übrigen Fällen die Infektion asymptomatisch verläuft. Klinische Beschwerden äußern sich in Form von grippeähnlicher Symptomatik wie starken retroorbitalen Kopfschmerz, Fieber, Mattigkeit, Gliederschmerzen und Schüttelfrost. Bei ca. 10-20 % der symptomatischen Fälle tritt eine atypische Pneumonie und/oder granulomatöse Hepatitis auf. Sehr selten führt die Infektion zu einer Myokarditis, Perikarditis oder Meningoenzephalitis. Die Infektion während der Schwangerschaft kann das Risiko für eine Fehlgeburt (meist bei einer Erstinfektion im ersten Schwangerschaftsdrittel), eine Frühgeburt, eine Plazentitis (Entzündung der Plazenta), die in der Folge zum Abort führen kann, oder ein geringes Geburtsgewicht des Neugeborenen erhöhen. Eine Übertragung im Mutterleib mit Spätfolgen für das Kind wurde bisher nicht beschrieben. Eine akute Coxiella burnetii-Infektion führt in ca. 1 % der Fälle zu einem chronischen Q-Fieber d.h. einer Chronifizierung (mehr als 6 Monate persistierende Infektion), die sich sehr häufig in Form einer Endokarditis klinisch manifestiert. Sehr viel seltener treten z.B. eine granulomatöse Hepatitis oder eine Osteomyelitis auf. Die chronische Erkrankung ist langwierig zu therapieren (mehrere Jahre) und weist in Verbindung mit einer hohen Komplikationsrate unbehandelt eine Mortalität von bis zu 40 % auf. Nach einem akuten Q-Fieber kann zusätzlich ein Post-Q-Fieber-Müdigkeitssyndrom (Q fever fatigue syndrome – QFS) auftreten. Die häufigsten Symptome des QFS umfassen: Müdigkeit (Fatigue), Beeinträchtigung im Alltag, Konzentrationsschwäche, Muskelschmerzen, Nachtschweiß. Auch wird oft von Betroffenen geschildert, dass das vor der Erkrankung vorhandene Leistungs- und Arbeitsniveau nach einem Jahr nicht wieder erreicht wurde. Bei Tieren können die Symptome ganz unterschiedlich ausgeprägt sein. Besonders bei Schafen kann eine Infektion mit C. burnetii ohne klinische Anzeichen einer Erkrankung verlaufen. Bei Ziegen kommt es häufig zur Geburt lebensschwacher Lämmer und zu Aborten. Das klinische Bild fällt beim Rind sehr unterschiedlich aus und reicht von symptomlos über verlängerte Zwischenkalbezeit, Nachgeburtsverhalten bis hin zum Abort. Im Gegensatz dazu, kommt es bei Ziegen und Rindern häufig zum Abort. Generell können folgende Symptome mit Q-Fieber bei Hauswiederkäuern in Verbindung gebracht werden: Fertilitätsprobleme, Fehlgeburt, Totgeburt, Geburt lebensschwacher Lämmer bzw. Kälber, verzögerter Abgang der Nachgeburt. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Beim Menschen ist eine akute C. burnetii-Infektion mit Antibiotika (z.B. Doxycyclin) gut behandelbar. Im Fall eines chronischen Verlaufs sowie bei Vorerkrankungen oder bei einer Erkrankung vor/während einer Schwangerschaft ist eine langandauernde Antibiotika-Therapie notwendig. Ein Impfstoff für Menschen ist nur in Australien zugelassen und gegebenenfalls mit Nebenwirkungen verbunden. Die Erregerausscheidung beim Tier kann, nach aktuellem Stand der Wissenschaft, durch Medikamentengabe nicht verhindert werden. Eine Behandlung mit Oxytetrazyklin führt nicht zu einer signifikanten Reduzierung der Erregerausscheidung. Ein Impfstoff ist in Deutschland für Rinder und Ziegen zugelassen und kann für Schafe umgewidmet werden. Dieser Impfstoff senkt die Erregerausscheidung der Tiere langfristig, kann sie aber nicht vollständig verhindern. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Akutes Q-Fieber beim Menschen ist eine in der Bundesrepublik Deutschland nach dem Infektionsschutzgesetz (IfSG) meldepflichtige Erkrankung. Dem Gesundheitsamt wird gemäß § 7 Abs. 1 IfSG der direkte oder indirekte Nachweis von C. burnetii, soweit er auf eine akute Infektion hinweist, namentlich gemeldet. In der Veterinärmedizin ist der direkte Nachweis von C. burnetii bei Wiederkäuern in Deutschland nach der Verordnung über meldepflichtige Tierkrankheiten (TKrMeldpflV) meldepflichtig. Dabei sind die Leiter der Veterinäruntersuchungsämter, der Tiergesundheitsämter oder sonstiger öffentlicher oder privater Untersuchungsstellen , die in Ausübung ihres Berufes meldepflichtige Krankheiten feststellen, verpflichtet, das Auftreten der Krankheit oder des Erregers unverzüglich der nach Landesrecht zuständigen Behörde unter namentlicher Angabe des betroffenen Bestandes, des Datums der Feststellung der betroffenen Tierarten und des Kreises oder der kreisfreien Stadt zu melden. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
Welche Bekämpfungsstrategien gibt es? |
|
Voraussetzung für die Maßnahmen der Verhütung und Bekämpfung dieser Infektion beim Menschen ist das rechtzeitige Erkennen von Infektionen bei Tieren. Die Vermeidung des Kontaktes zu erregerausscheidenden Tieren stellt die wichtigste Vorbeugungsmaßnahme dar. Beim Auftreten von Q-Fieber-Erkrankungen ist eine enge Zusammenarbeit von Gesundheitsamt und Veterinäramt erforderlich, um die Infektionsquelle aufzuspüren und weitere Erkrankungsfälle in der Bevölkerung zu verhindern. Eine zentrale Bekämpfungsstrategie beinhaltet die Beachtung von Schutz- und Hygienemaßnahmen bei Geburtshilfe und Schur. Bei einem Erregernachweis ist auch das Desinfizieren der Stallungen, Arbeitsmaterialien und Arbeitskleidung essentiell. Zusätzlich sollten Rohmilch oder Rohmilchprodukte nicht mehr an den Verbraucher abgegeben werden. Pasteurisieren inaktiviert C. burnetii. Eine Impfung der Schafe, Ziegen und Rinder wird empfohlen. |
|
Wo liegen zukünftige Herausforderungen? |
|
Aufgrund der unspezifischen Symptome kann das Q-Fieber beim Menschen leicht mit einem grippalen Infekt verwechselt werden, so dass gegebenenfalls eine adäquate Behandlung mit Antibiotika nicht frühzeitig begonnen werden kann, um z.B. den möglichen Übergang in ein chronisches Q-Fieber zu verhindern. Das Post-Q-Fieber-Müdigkeitssyndrom (Q fever fatigue syndrome – QFS) stellt diagnostisch und therapeutisch eine Herausforderung dar, da sich die Erkrankung durch Antibiotikagabe nicht beeinflussen lässt und kein eindeutiger Labornachweisparameter existiert. Deshalb werden psychosomatische und verhaltenstherapeutische Behandlungsansätze empfohlen.
Weitere Informationen:
|
Für die fachliche Unterstützung bei der Erstellung des Coxiella burnetii-Steckbriefes danken wir dem Q-GAPS Konsortium, insbesondere PD Dr. Anja Lührmann (Universitätsklinikum Erlangen).
Dezember 2020 - Trichophyton benhamiae
Abb.: Die Transmission des West-Nil-Virus erfolgt zwischen Stechmücken und Vögeln, aber auch Menschen und Pferde können sich mit dem Virus infizieren (Copyright: Dana A. Thal)
|
Beschreibung |
|
Das West-Nil-Virus (WNV), durch Stechmücken übertragbar, gehört zu der Familie der Flaviviridae, speziell zum Genus Flavivirus und gliedert sich aufgrund der ausgeprägten Kreuzreaktivität in den Japan-Enzephalitis-Virus-Serokomplex. Das Genom des RNA-Arbovirus ist einzelsträngig und von positiver Polarität. Membranbestandteile des behüllten Virions, welches 40-60 nm im Durchmesser groß ist, sind das virale Glykoprotein E sowie das Glykoprotein prM, welche insbesondere die Zielantigene für virusneutralisierende Antikörper verkörpern. Phylogenetisch lässt sich das WNV in derzeit bis zu neun Linien klassifizieren, von denen WNV-Linie 1 und 2 vorrangig für Ausbrüche in Wirbeltieren in Europa verantwortlich sind. |
|
Erstmals entdeckt |
|
Das WNV wurde erstmals im Jahr 1937 aus dem Blut einer fiebernden Patientin aus der West-Nil-Provinz Ugandas isoliert. Die Frau wurde aufgrund eines Gelbfieber-Verdachts untersucht, wobei dieses neue Virus entdeckt wurde. In den folgenden Jahren erhielt das WNV wenig Aufmerksamkeit, obwohl es schon Ende der 1950er Jahre Europa erreichte. Als jedoch im Jahr 1999 die ersten schweren humanen Erkrankungsfälle aus den USA gemeldet wurden, verbunden mit massenhaftem Versterben der regionalen Vogelpopulation, gelang WNV erstmals in den Fokus der Öffentlichkeit. Ende der 1990er Jahre breitete sich das Virus wieder verstärkt in Europa aus und auch hier nahm das Bewusstsein und das Interesse für das Virus nun deutlich zu. |
|
Wo kommt der Erreger vor? |
|
Das WNV kommt mittlerweile auf allen Kontinenten vor, außer in der Antarktis. Es stellt damit das geografisch am weitesten verbreitete von Mücken übertragbare Virus dar. Dabei ist es sowohl in tropischen, als auch in gemäßigten Gebieten der Erde verbreitet. |
|
Betroffene Tierspezies, Reservoir |
|
In den gemäßigten Breiten Europas zirkuliert das Virus in einem enzootischen Zyklus zwischen verschiedenen Wildvögeln und unterschiedlichen Steckmückenarten. Zu den Reservoir- beziehungsweise Amplifikationswirten, zählen unter anderem Sperlingsvögel (v. a. Rabenvögel) sowie Greif- und Eulenvogelarten. Die Übertragung im enzootischen Zyklus findet hauptsächlich durch ornithophile Stechmückenarten der Gattung Culex statt. Mückenarten, die sich nicht wirtsspezifisch ernähren, sondern Blut von verschiedenen Spezies saugen, also sowohl an Vögeln als auch an Säugern ihre Blutmahlzeit nehmen, nennt man Generalisten. Wenn durch diese sog. Generalisten das Virus aus dem Vogelkreislauf in Säugetierspezies gelangt, bezeichnet man den Überträger als Brückenvektor. WNV kann durch solche Brückenvektoren zahlreiche Säugetier- aber auch Reptilien- und Amphibienarten infizieren, welche jedoch nur Fehlwirte bzw. Endwirte einer Infektion darstellen. Lediglich der Mensch und das Pferd können bei einer Infektion auch Krankheitssymptome aufzeigen. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Der Mensch wird infiziert, wenn er von einer mit WNV-infizierten Mücke (vor allem durch Vertreter der Gattung Culex) gestochen wird. Die Übertragung von Mensch zu Mensch kann aber auch durch Bluttransfusionen, Organtransplantationen oder in seltenen Fällen durch Stillen oder im Mutterleib erfolgen. Weiterhin sind seltene humane Infektionen über Laborunfälle wie Stiche mit infizierten Nadeln, Skalpellen etc. beschrieben. Ein Risiko für autochthone WNV-Infektionen besteht vor allem für ältere, vorerkrankte und immunsupprimierte Menschen, vorrangig im Spätsommer. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Die WNV-Infektion verläuft je nach betroffener Spezies unterschiedlich: Hoch empfängliche Vogelordnungen wie Sperlings-, Greif-, und Eulenvögel können schwere (neurologische) Krankheitssymptome bis hin zu tödlichen Enzephalitiden entwickeln. Andere weniger empfängliche Vogelordnungen, wie z.B. Hühner- und Entenvögel, zeigen oft keinerlei klinische Symptome. Bei Säugetieren verläuft die WNV-Infektion asymptomatisch. Lediglich bei Pferden und Menschen kann es in seltenen Fällen zum sogenannten WNV-Fieber kommen. Dabei zeigen sich nach einer Inkubationszeit von 2-14 Tagen Fieber (teilweise biphasisch), Schüttelfrost, Kopf- und Rückenschmerzen, Abgeschlagenheit und Lymphknotenschwellungen. In Einzelfällen kann es sogar zu neurologischen Symptomen und zum Tod kommen. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt derzeit keine spezifische Therapiemöglichkeiten. Eine Infektion kann daher nur symptomatisch und bei Bedarf intensivmedizinisch therapiert werden, was jedoch nicht sicher vor einem neuroinvasiven Verlauf schützt. In Europa sind drei Impfstoffe gegen WNV für Pferde zugelassen. Die Impfstoffe schützen nicht vor einer Infektion, aber vor einem schweren klinischen Verlauf und sie verkürzen die Dauer der Virämie und verringern die Viruslast deutlich. Neben einem klassischen Totimpfstoff gibt es einen rekombinanten Lebendimpfstoff auf Kanarienpockenbasis und eine inaktivierte Chimäre auf der Basis eines Gelfieber-Impfstammes, die prophylaktisch genutzt werden können. Die Empfehlung der Ständigen Impfkommission Veterinärmedizin (StIKo Vet) lautet derzeit, Pferde, die im bekannten WNV-Endemiegebiet gehalten werden oder die während der Mückensaison z.B. im Rahmen von Pferdesportveranstaltungen in diese Gebiete verbracht werden, gegen WNV zu impfen. Hierfür sollte die zweimalige Grundimmunisierung vor Beginn der Mückensaison, d.h. vor Ende Mai, abgeschlossen sein. Weltweit ist derzeit kein WNV-Impfstoff für Menschen oder Vögel zugelassen, aber humane Impfstoffe befinden sich derzeit in klinischen Phase II Studien. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Seit vielen Jahren werden verendete Vögel deutschlandweit auch auf das Vorhandensein einer WNV-Infektion hin untersucht. Bei Pferden erfolgt dies derzeit noch nicht regelmäßig. Hintergrund ist dabei, dass eine WNV-Infektion bei Vögeln und Pferden eine anzeigepflichtige Tierseuche in Deutschland ist. Anzeigepflichtig sind ein direkter Erregernachweis aus Blut oder Organproben bei Vogel und Pferd sowie ein indirekter IgM-Nachweis aus Serum oder Plasma mittels ELISA beim Pferd. Für die humane WNV-Infektion besteht nach §7, Abs. 1 des Infektionsschutzgesetzes eine Meldepflicht für den direkten oder indirekten Erregernachweis. Das Nationale Referenzlabor (NRL) am Friedrich-Loeffler-Institut (FLI) koordiniert seit vielen Jahren ein ausgedehntes Vogelüberwachungsnetzwerk mit deutschlandweiten Kooperationspartnern aus der Avifauna, wie privaten und universitären Vogelkliniken, Ornithologen, ornithologischen Forschungsstationen, dem Bernhard-Nocht-Institut für Tropenmedizin (BNITM) in Hamburg, dem Naturschutzbund (NABU), den amtlichen Veterinäruntersuchungsämtern der Länder und seit kurzem auch mit vielen zoologischen Einrichtungen. Dieses Netzwerk trägt dazu bei, ein möglichst flächendeckendes Monitoring jährlich zu ermöglichen, indem verstorbene oder klinisch auffällige Wildvögel untersucht werden. Zudem tragen die routinemäßigen Blutuntersuchungen bei Zoovögeln zur Status-quo-Ermittlung in der Region bei. So konnte dieses Netzwerk den Eintritt von WNV in Deutschland und die Etablierung dieses neuen Erregers genau aufzeigen und ist als ein wichtiges Frühwarnsystem für die Humanmedizin anzusehen. Zusätzlich wird seit vielen Jahren deutschlandweit das Vorkommen der unterschiedlichsten Stechmückenarten überwacht und jährlich kartiert. Die Ergebnisse werden im Mückenatlas einer breiten Öffentlichkeit zur Verfügung gestellt (https://mueckanatlas.com). Weiterhin werden in verschiedenen Forschungsprojekten ausgewählte Stechmückenspezies auf potentielle Pathogene untersucht. In diesem Kontext werden auch erste Ansätze von verbesserten Mückenfallensystemen erprobt, die über die Sammlung von Mückenspeichel auf sog. FTA-Karten noch schneller wichtige Pathogene in einzelnen Regionen identifizieren können. Außerdem werden auf Anordnung des Paul-Ehrlich-Instituts (PEI) alle nicht inaktivierten Blutprodukte nach einer Blutspende aus WNV-Endemiegebieten zwischen dem 1. Juni und 30. November mittels WNV-NAT (Nukleinsäure-Amplifikationstechnik) untersucht oder für vier Wochen von der Spende zurückgestellt. Jedoch gelten Blut- und Plasmaprodukte als sicher und können WNV nicht übertragen, wenn sie mit validierten Verfahren zur Virusinaktivierung behandelt wurden. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Da zwischen den Flaviviren enge Antigengemeinschaften bestehen, kann das gleichzeitige Vorkommen mehrerer Flaviviren serologische Kreuzreaktionen hervorrufen. Von großem Interesse ist die Fragestellung, ob eine vorausgegangene Flavivirus-Infektion mit einem anderen Erreger, eine koprotektive Wirkung auf eine nachfolgende WNV-Infektion hat und den Verlauf einer Infektion abmildert. Denkbar wären solche schützenden Wirkungen einer vorangegangenen Flavivirus-Infektion bei dem seit vielen Jahren in Europa, inklusive Deutschland, zirkulierendem Usutu-Virus (USUV) oder bei dem in Spanien zirkulierendem Bagaza-Virus (BAGV). Verschiedene Forschungsgruppen gehen diesen Fragestellungen derzeit nach. Ein weiterer Forschungsschwerpunkt ist die Prophylaxe einer WNV-Infektion bei Zoovögeln, um damit wertvolle Zucht- und Zoovögel zu schützen. Erste Feldstudien haben dazu begonnen, um diese hochempfängliche Vogelspezies mithilfe eines kommerziell erhältlichen Pferdevakzines sicher vor einer Infektion in WNV-Endemiegebieten zu schützen. Des Weiteren verfolgen viele Forschungsgruppen das Ziel, verbesserte ELISAs oder andere serologische Tools zu entwickeln und zur Marktreife zu bringen, die sicher zwischen verschiedenen nah verwandten Flaviviren, wie beispielsweise Dengue-Virus und seinen Serotypen, Zika-Virus, USUV oder Frühsommer-Meningoenzephalitis-Virus (FSMEV), bei Mensch und Tier differenzieren können. |
|
Welche Bekämpfungsstrategien gibt es? |
|
In Deutschland gibt es derzeit keine Bekämpfungsstrategie, weder in der Humanmedizin, noch in der Veterinärmedizin. Eine wichtige Prophylaxe für den Menschen zur Vermeidung von Mückenstichen ist das Tragen langer Kleidung sowie das Verwenden von Repellentien und Moskitonetzen/-gittern in WNV-endmischen Regionen. Um eben diese WNV-Endemiegebiete zu kennen, ist ein akribisches Überwachungsnetzwerk sowie eine gute Aufklärung/Beteiligung der Öffentlichkeit essentiell. Des Weiteren sollten stehende Gewässer (z. B. in Regentonnen) vermieden werden, um die Hausmücke als Hauptüberträger zu dezimieren. Die Anwendung solcher Präventivmaßnahmen sollte die erste Bekämpfungsmaßnahme sein, bevor der lokale/regionale Einsatz von Bioziden (v.a. Adultiziden) angedacht wird. Es wird empfohlen Pferde, die im bekannten WNV-Endemiegebiet gehalten werden oder die während der Mückensaison z.B. im Rahmen von Pferdesportveranstaltungen in diese Gebiete verbracht werden, gegen WNV zu impfen (StIKo Vet). |
|
Wo liegen zukünftige Herausforderungen? |
|
Der Klimawandel hat die Etablierung von WNV in Deutschland begünstigt: Längere und wärmere Sommer erleichtern die Ausbreitung von Stechmücken und deren Pathogenen, da sich auch die Zeit der Virusvermehrung nach einer Blutmahlzeit in den Stechmücken bei höheren Umgebungstemperaturen deutlich verringert, wodurch das Virus schneller an den nächsten Wirbeltierwirt weitergegeben werden kann. Gleichzeitig halten sich Menschen bei warmen Temperaturen vermehrt im Freien auf und erhöhen dadurch ihr Risiko, gestochen zu werden und sich mit dem Virus zu infizieren. Auch warme Winter bieten den Mücken gute Bedingungen für die Überwinterung, was bereits für Stechmücken in einem Überwinterungshabitat in Deutschland gezeigt werden konnte. Daher ist zukünftig eine regionale Verbreitung in Deutschland und möglicherweise darüber hinaus nord- und westwärts in Europa sehr wahrscheinlich. Der erste WNV-Nachweis in einem Vogel und in Stechmücken in den Niederlanden erfolgte im September 2020, gefolgt von der ersten bestätigten humanen WNV-Infektion einem Monat später in dieser Region. |
| Sonstiges |
|
Nationales Referenzlabor für West-Nil-Virus (WNV) am FLI Interview zur WNV Ausbreitung in Deutschland (Teil 1, Teil 2, Teil 3) |
Für die fachliche Unterstützung bei der Erstellung des West-Nil-Virus-Steckbriefes danken wir Dr. Cora M. Holicki, Hannah Reemtsma, Felicitas Bergmann und Dr. Ute Ziegler vom Institut für neue und neuartige Tierseuchenerreger am Friedrich-Loeffler-Institut.
8 unterschiedliche T. benhamiae Isolate, 4 vom Meerschweinchen (GP) und 4 von Menschen (hum), gezeigt ist Ober- (obverse) und Unterseite (reverse), (Bild: C. Baumbach, Uni Leipzig)
|
Beschreibung |
|
Trichophyton benhamiae ist ein zoophiler Dermatophyt (Fadenpilz, der Pilzinfektion der Haut auslösen kann). Er kommt in zwei Varianten vor:
Seine Morphologie ist leicht mit anderen Pilzen zu verwechseln (M. canis, T. mentagrophytes) weshalb eine Differenzierung mittels molekularbiologischer Methoden empfohlen wird (insbesondere Sequenzierung best. Genregionen). |
|
Erstmals entdeckt |
|
T. benhamiae wurde erstmals 1998 von einem Kaninchen in Japan isoliert. 2002 wurde der Erreger erstmals von zwei menschlichen Patienten mit Tinea corporis (Dermatophytose von Rumpf und Extremitäten) in Japan isoliert. Diese hatten sich vermutlich an einem Kaninchen infiziert. |
|
Wo kommt der Erreger vor? |
|
Der Erreger ist weltweit verbreitet. |
|
Betroffene Tierspezies, Reservoir |
|
Als Erregerreservoir dienen vorrangig kleine Nagetiere, vor allem Meerschweinchen, aber auch andere Nager und Kleinsäuger. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Eine Infektion erfolgt vorrangig durch direkten Kontakt mit asymptomatischen oder infizierten Tieren. Zudem kann es zu einer Infektion über unbelebte Vektoren kommen, wie Einstreu oder Gegenstände im Käfig. Die Sporen der Pilze sind sehr widerstandsfähig und können bis zu mehrere Jahre bei unzureichender Reinigung und Desinfektion überdauern. Häufig betroffen sind Kinder und Jugendliche, was vermutlich auf einen oft engen Kontakt mit ihren Haustieren zurückzuführen ist (es ist nicht abschließend geklärt, ob sie ggf. auch besonders empfänglich sind). Gefährlich kann eine Infektion für immunsupprimierte Patienten werden. |
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
T. benhamiae löst vor allem bei Kindern und Jugendlichen Dermatophytosen aus. Am häufigsten sind hierbei sind Tinea corporis und Tinea faciei. Hierbei kommt es zu Entzündungen der Haut (rundliche, abgegrenzte Hautläsionen) am Körper und im Gesicht mit teilweise starkem Juckreiz. In einigen Fällen sind auch Kopfhaut und Haare betroffen (Tinea capitis) bis hin zu Kerion celsi (entzündlich-eitrige Kopfhautinfektion, oft mit dauerhaftem Haarausfall). Da alle genannten Merkmale mehr oder weniger stark auftreten können, kann das Krankheitsbild sehr variabel ausfallen. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt verschiedene gut wirksame Medikamente. Hierbei sollte die Pilzart genau differenziert werden, um der Entstehung von Resistenzen entgegen zu wirken. Die Wirkstoffe werden häufig in Form von Cremes (Amorolfin, Clotrimazol, Ciclopiroxolamin, Naftifin etc.) verschrieben. Bei schwerer oder renitenten Fällen können die Wirkstoffe auch systemisch verabreicht werden (Terbinafin, Itraconazol, Fluconazol). Die größte Herausforderung für eine erfolgreiche Therapie ist die notwendige lange Behandlungsdauer (mehrere Wochen bis Monate, bei Nagelpilz auch über ein Jahr), was oft zu einer fehlenden Compliance bei den Patienten führt. Einen humanen Impfstoff gibt es nicht. Für manche Tierarten gibt es Impfstoffe, welche jedoch keine Re-Infektion verhindern, sondern lediglich Symptome und Infektionsdauer verkürzen können. Dermatophytosen sind teilweise auch selbstausheilend, sollten aber aufgrund der hohen Ansteckungsgefahr dennoch behandelt werden. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Dermatophytosen sind nicht meldepflichtig, nur in besonderen Fällen, wenn z.B. mehrere Kinder in kurzen Abständen aus derselben Kita mit denselben Symptomen beim gleichen Arzt vorstellig werden. Die tatsächlichen Infektionszahlen können daher höher liegen als offiziell angegeben. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Ein Forschungsbereich ist der Einfluss von bestimmten Prädisposition (Stress, Alter) auf die Infektion mit T. benhamiae. Ein weitere Forschungsfrage ist, was zu einer Chronizität der Infektion führt. Aber auch Virulenzfaktoren und geeignete experimentelle Systeme, die den in vivo Zustand real abbilden, sind Themen in der Forschung. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Ein wichtiger Ansatzpunkt ist die Prävention. Hierbei ist es wichtig, Menschen für die Gefahr von Pilzinfektionen zu sensibilisieren, damit sie im Schwimmbad Badeschlappen tragen und in den Skiurlaub den eigenen Helm und Schuhe mitnehmen, die eigene Haarbürste alleine nutzen, in Saunen und Fitnessstudios auf geeignete Unterlagen achten, nicht einfach so fremde Tiere streicheln und beim Neukauf von Haustieren (v.a. Meerschweinchen) einen prophylaktischen Besuch beim Tierarzt in Erwägung ziehen. Bei der Behandlung von Erkrankten ist es wichtig, dass diese stringent den Anweisungen des behandelnden Arztes folgen. Auch eine gründliche Reinigung und Desinfektion der Umgebung von infizierten Patienten (Kleidung, Kuscheltiere, und Sofas u. ä.) ist wichtig. |
|
Wo liegen zukünftige Herausforderungen? |
|
Für die Zukunft sollte eine exakte Diagnostik in Routinelaboren implementiert werden, um Fehldiagnosen zu vermeiden. Diese beeinträchtigen nach wie vor epidemiologische Studien und weiterführende Forschung. Zudem ist es wichtig Hautärzte auf das Thema zu sensibilisieren und insbesondere nach Aufenthalten in wärmeren Ländern aufmerksam zu sein (dort sind einige Dermatophyten weiter verbreitet als in Deutschland). In Indien sind bereits resistente Hautpilze auf dem Vormarsch, die weite Teile der Bevölkerung befallen. Auch hier ist es wichtig Achtsamkeit zu praktizieren, um der weiteren Verbreitung von resistenten Pilzerregern vorzubeugen. |
Für die fachliche Unterstützung bei der Erstellung des Toxoplasmose Steckbriefes danken wir Christina Baumbach (Universität Leipzig) und Prof. Dr. Pietro Nenoff (Universitätshautklinik Leipzig)
November 2020 - FSME-Virus

3 Stadien (Larve, Nymphe, adulte Männchen/Weibchen) von Ixodes ricinus, der wichtigste Überträger des FSME-Virus in Mitteleuropa (Bild: PD Dr. G. Dobler, Institut für Mikrobiologie der Bundeswehr)
|
Beschreibung |
|
Das Frühsommer-Meningoenzephalitis (FSME)-Virus ist Mitglied des Genus Flavivirus, der Familie Flaviviridae. Es wird in die „Mammalian Tick-borne group“ eingruppiert. Insgesamt gibt es mindestens 5 Subtypen (Europäischer, Sibirischer, Fernöstlicher, Baikal, Himalaya). Es handelt sich um ein behülltes Virus. Sein Genom enthält ca. 11.000 Nukleotide (nt) in Form einer Einzelstrang RNA positiver Polarität. |
|
Erstmals entdeckt |
|
Die Erstbeschreibung des FSME-Virus erfolgte 1930 durch Hans Schneider in Neunkirchen, Niederösterreich („Schneidersche Krankheit“). 1937 wurde das Virus von Prof. Dr. Lev Zilber im Fernen Osten Russlands, bei Khabarovsk, beschrieben. Die Entdeckung des FSME-Naturherds erfolgte 1938 durch Prof. Evgenji Pawlowsky. 1949 gelang die Erstisolierung des FSME-Virus in Europa durch Dr. Frantisek Gallia in der Tschechoslowakei. |
|
Wo kommt der Erreger vor? |
|
Der Erreger kommt auf dem eurasiatischen Kontinent im sogenannten borealen Nadelwaldgürtel von England im Westen bis Japan im Osten vor. Im Norden reichte seine Verbreitung bis Schweden und Finnland. Im Süden erstreckt sich das Verbreitungsgebiet bis zum Mittelmeer, Schwarzes Meer, Transkaukasien, Mongolei und Südkorea. |
|
Betroffene Tierspezies, Reservoir |
|
Vektor und Reservoir des FSME-Virus sind verschiedene Schildzeckenarten. In Mitteleuropa ist es vor allem Ixodes ricinus, in Russland v.a. Ixodes persulcatus und in Japan und Südkorea Ixodes ovatus. Seltener sind auch Buntzecken (Dermacentor)-Arten Reservoir des Virus (u.a. Dermacentor reticulatus in Sachsen, Sachsen-Anhalt, Russland, Mongolei u.a.). Natürliche Wirte für das Virus sind Kleinsäuger, u.a. Rötelmaus, Gelbhalsmaus, und Insektivoren. Mensch und größere Wildtiere und Haustiere gelten als zufällige Fehlwirte, die nicht an der Zirkulation des FSME-Virus beteiligt sind. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Natürliche Infektion erfolgen überwiegend durch Zeckenstich, seltener auch durch Verzehr unbehandelter Milch und Milchprodukte von Haustieren (Ziegen, Kühe, Schafe). Zudem sind Laborinfektionen durch Aerosol und Penetration virushaltiger Materialien durch die Haut möglich. Risikogruppen sind alle Personen, die Kontakt mit der Vegetation und damit mit Zecken haben. Vor Einführung der Impfung waren v.a. Waldarbeiter und Landwirtschaftsarbeiter betroffen. Durch die Impfung der Risikogruppen kommen heute ca. 90% der Infektionen durch Freizeitaktivitäten zustande (Pilzsuchen, Wandern, Gartenarbeit, Spazierengehen). |
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Neben dem Menschen sind selten Hunde, Pferde, sehr selten Schafe und evtl. Mufflons betroffen. Hier kann es zu einer Enzephalitis kommen. Beim Menschen ist häufig ein biphasischer Verlauf zu beobachten. Bei der ersten Phase handelt es sich um einen unspezifischen Allgemeininfekt und bei der zweiten Phase um eine Organphase (Meningitis, Enzephalitis, Myelitis). Die Letalität in Europa liegt bei ca. 1-2%. In Russland liegt sie Letalität durch sibirische und fernöstliche Subtyp-infektionen möglicherweise bei bis zu 20%. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt keine ursächlich wirksamen Medikamente gegen das FSME-Virus. Als Therapie kommt alleinig die medikamentöse Behandlung von Symptomen zur Anwendung, die den Verlauf der Erkrankung nicht grundlegend verändern kann. Es sind 2 Impfstoffe (jeweils als Erwachsenen- und Kinder-Impfstoff) verfügbar, die nach kompletter Grundimmunisierung einen Impfschutz von > 95% aufweisen. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Die FSME ist in der gesamten EU meldepflichtig. In Deutschland ist die diagnostisch nachgewiesene FSME-Infektion meldepflichtig. Die Meldung erfasst ausschließlich humane Fälle auf Landkreisebene. Der Nachweis von FSME-Virus in Zecken oder der Nachweis von Antikörpern in Wild-/Haustieren sind nicht meldepflichtig. Nachdem der Mensch ein Fehlwirt für das FSME-Virus ist, zielt das deutsche Meldesystem nur auf humane Fälle und nicht auf die eigentliche Verbreitung des FSME-Virus ab. Als Risiko-Landkreise werden Landkreise bezeichnet die in 5 Jahren eine Inzidenz von 1/100.000 überschreiten. Landkreise mit einzelnen Erkrankungsfällen werden damit nicht als Risiko-Landkreise erfasst. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Aktuell gibt es noch eine große Anzahl an Forschungsfragen: Welche geographische Ausdehnung haben FSME-Naturherde und wie werden diese Herde über Jahrzehnte stabil gehalten? Welche Faktoren führen zu einer Anpassung des VFSME-Virus an Vektoren und Wirtstiere? Welche Auswirkungen haben die Änderungen des Wetters der letzten Jahre auf die Epidemiologie der FSME (sowohl Auftreten neuer als auch Verschwinden bekannter Risikogebiete)? Wie breitet sich das FSME-Virus aus? Welche epidemiologischen Risikofaktoren gibt es für FSME in unserer modernen Gesellschaft? Gibt es Virusstämme mit unterschiedlicher Pathogenität in der Natur? Wie und warum ist das FSME-Virus neuropathogen? |
|
Welche Bekämpfungsstrategien gibt es? |
|
Zum einen ist die Aufklärung über das Risiko von FSME-Infektionen eine wichtige Maßnahme. Zum anderen ist die Identifizierung von Risikofaktoren für humane FSME-Infektionen wichtig. Auch eine gezielte Propagierung der FSME-Impfung bei Populationen mit erhöhtem Infektions-Risiko kann einen wichtigen Beitrag leisten. Zudem wird die experimentelle Eliminierung von FSME-Naturherden durch den Einsatz biologischer Maßnahmen untersucht (Zeckenbekämpfung, Nagetier-Bekämpfung). |
|
Wo liegen zukünftige Herausforderungen? |
|
In den vergangenen 3 Jahren konnte eine dramatische Zunahme der Zeckenpopulationen mit gesteigertem Risiko von FSME-Infektionen beobachtet werden mit einem tendenziell deutlichen Anstieg der FSME-Fälle in höher gelegenen Regionen Deutschlands. Die Bedeutung des Klimawandels für die Verbreitung von Vektoren, natürlichen Wirten und auf die Replikation des Virus im Naturzyklus muss zukünftig beachtet werden. Zudem ist eine verbesserte Impfprophylaxe durch besseres Verstehen von Pathogenitäts- und Immunitätsmechanismen ein zukünftiges Ziel, sowie die verbesserte Durchimpfungsraten in Risiko-Landkreisen durch innovative Aufklärungsstrategien. Auch die Entwicklung von antiviral wirksamen Medikamenten gegen FSME-Virus (und andere Flaviviren) ist ein wichtiges Thema, sowie das verbesserte Verstehen des FSME-Virus- Übertragungszyklus zur Etablierung ökologischer Bekämpfungsmaßnahmen in Naturherden. |
|
Sonstiges |
|
Weitere Informationen können auf der Seite des Nationalen Konsiliarlabors für Frühsommer-Meningoenzephalitis (FSME) des Instituts für Mikrobiologie der Bundeswehr gefunden werden. |
Für die fachliche Unterstützung bei der Erstellung des FSME-Virus Steckbriefes danken wir PD Dr. Gerhard Dobler, Leiter des Nationales Konsiliarlabor für Frühsommer-Meningoenzephalitis (FSME) am Institut für Mikrobiologie der Bundeswehr.
Oktober 2020 - Toxoplasma gondii
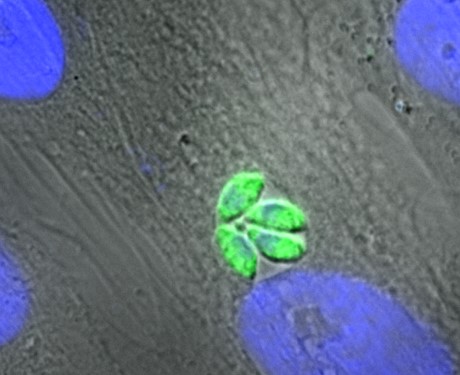
Toxoplasma gondii in seinem pathogenen Stadium als Tachyzoit (in grün). Grau: Wirtszellen, blau: Zellkerne der Wirtszellen und des Parasiten (Bild: M. Blume (RKI))
|
Beschreibung |
|
T. gondii ist ein obligat intrazellulärer Parasit, der im Laufe seines Lebenszyklus sehr verschiedene Erscheinungsformen einnimmt. Er gehört zu den sogenannten Apicomplexa zu denen auch Erreger der Malaria und Kryptokkose gehören. |
|
Erstmals entdeckt |
|
T. gondii wurde erstmals 1902 von Charles Nicolle und Louis Manceaux als Parasit in dem afrikanischen Nager Gundi entdeckt. |
|
Wo kommt der Erreger vor? |
|
Der Erreger ist weltweit verbreitet. Besonders diverse und virulente Stämme des Parasiten kommen auf dem südamerikanischen Kontinent vor. |
|
Betroffene Tierspezies, Reservoir |
|
T. gondii infiziert alle warmblütigen Tiere, inklusive dem Menschen. Besondere Bedeutung kommt katzenartigen Wirtstieren zu. Nur sie scheiden nach Infektion sogenannte Oozysten aus. Diese Form des Parasiten ist die einzige außerhalb von Wirtstieren vorkommende und umweltstabile Form des Parasiten. Sie sind das Produkt seines sexuellen Vermehrungszyklus, der exklusiv im Darmepithel von Katzen stattfindet. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Infektionen mit T. gondii finden durch Aufnahme kontaminierter Nahrung statt. Dabei werden entweder Oozysten aus der Umwelt oder sog. Gewebszysten aus ungenügend gegarten Fleischprodukten mit der Nahrung aufgenommen. Risikogruppen mit potentiell schwerem Krankheitsverlauf sind immunsupprimierte Personen und Schwangere. So treten in ersteren oft schwere neuronale Schäden durch eine rasche Vermehrung des Parasiten auf, die unbehandelt zu einem tödlichen Krankheitsverlauf führen können. Risikogruppen mit erhöhten Serokonversionsraten beinhalten Gruppen mit geringerem sozioökonomischem Status und die Landbevölkerung. In allen einmal infizierten Personen oder Tieren überdauert der Parasit innerhalb von Gewebszysten. Das führt zu einer geschätzten Prävalenz von ca. 30% weltweit und einer 50%igen Seroprävalenz in Deutschland. |
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Eine akute Toxoplasmose manifestiert sich in unspezifischen Symptomen, die monatelang anhalten können und Fieber und Schmerzen in Gelenken und Muskeln beinhalten. In sonst gesunden Patienten ist die akute Toxoplasmose selbst limitierend und meist entweder symptomlos oder von leichten Grippe-ähnlichen Symptomen begleitet. Schwer verlaufende Formen mit besonders aggressiven Parasitenstämmen oder in immungeschwächten Patienten können allerdings bleibende neuronale Schäden, wie Blindheit und Taubheit, hinterlassen oder tödlich verlaufen. Eine Primärinfektion von Schwangeren kann abhängig vom Infektionszeitpunkt und Behandlungsbeginn zu schweren Fehlbildungen oder Todgeburten führen. Vereinzelt tritt auch eine Infektion der Retina in sonst gesunden Patienten auf, die mit einer Einschränkung des Sehvermögens verbunden ist. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Wie für alle eukaryotischen Krankheitserreger, gibt es derzeit keinen für Menschen zugelassenen Impfstoff gegen Toxoplasmose. Für Schafe ist mit ToxoVac ein Lebendimpfstoff, basierend auf einem attenuierten Parasitenstamm, zugelassen. Akute Infektionen mit T. gondii können mit dem Malariamedikament Atovaquone, mit Antifolaten, wie zum Beispiel Pyrimethamin, oder insbesondere bei Schwangeren mit Spiramycin behandelt werden. Diese Behandlungen sind nicht gegen chronisch infektiöse Gewebszysten aktiv, so dass es jeder Zeit du einem erneuten Krankheitsausbruch kommen. Es existiert momentan keine Therapie, die chronisch infektiöse Gewebszysten vollständig abtötet. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Deutschlandweit ist die konnatale Toxoplasmose meldepflichtig. Die akute Toxoplasmose ist dagegen nur in Sachsen meldepflichtig. Derzeit finden im Rahmen von KiGGS , DEGS und GERN Studien des Robert Koch-Instituts repräsentative Erhebungen der Serumprävalenzen in Deutschland statt. Dabei werden Antikörper gegen T. gondii in Blutproben nachgewiesen, welche auf eine stattgefundene Infektion deuten. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Toxoplasma dient als Modellorganismus für eine Reihe Apicomplexer Parasiten zu denen auch die Erreger der Malaria und Cryptosporidiose zählen. Dabei wird auf der Suche nach essentiellen Proteinen und Prozessen die ausgezeichnete genetische Zugänglichkeit T. gondiis in CRISPR-basierten Screens ausgenutzt. Ziel ist es Angriffspunkte für potentielle Wirkstoffe zu identifizieren. Ein Schwerpunkt stellt dabei die Invasion und der Exit aus Wirtszellen dar, deren Mechanismus in groben Zügen in Apicomplexa ähnlich ist. Eine weitere zentrale Fragestellung ist die nach molekularen Grundlagen und Mechanismen der Persistenz und Resistenz von Gewebszysten T. gondiis. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Eine zentrale Bekämpfungsstrategie sind Hygienemaßnahmen. So wird empfohlen potentiell mit Oozysten kontaminiertes Obst und Gemüse vor dem Verzehr zu waschen. Außerdem sollten Gewebszysten in Fleischprodukten durch vollständiges Garen bei Temperaturen über 65°C abgetötet werden. Schwangeren wird zudem empfohlen, das Säubern der Katzentoilette anderen Haushaltsmitgliedern zu überlassen, um Kontakt mit potentiell Oozysten-haltigen Kot zu minimieren. |
|
Wo liegen zukünftige Herausforderungen? |
|
Aktuelle Herausforderungen liegen in dem Eindämmen der verhältnismäßig hohen Prävalenz in Deutschland. Dafür ist ein vertieftes Verständnis des Beitrags von Infektionswegen nötig. Welcher Teil der Bevölkerung infiziert sich über eine Aufnahme von Oozysten oder Gewebszysten? Wesentlicher Bestandteil einer Strategie die Übertragungswege einzudämmen und ein Wiederaufleben akuter Toxoplasmose in chronisch infizierten Personen zu unterbinden beinhaltet sowohl die Entwicklung eines Wirkstoffes, der Gewebszysten eliminiert, als auch die Entwicklung von Impfstoffen für Nutztiere und Menschen. |
|
Sonstiges |
|
Weiter Informationen können auf den Seiten des Robert Koch-Institutes gefunden werden: https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Toxoplasmose.html |
Für die fachliche Unterstützung bei der Erstellung des Toxoplasmose Steckbriefes danken wir Dr. Martin Blume (Robert Koch-Institut).
September 2020 - Hepatitis E-Virus

Elektronenmikroskopische Aufnahme zweier HEV-Partikel (Dr. Ashish Gadicherla, BfR, Berlin)
|
Beschreibung |
|
Einzelsträngiges RNA-Virus aus der Familie Hepeviridae (Genus Orthohepevirus). Häufigste Ursache für akute Hepatitis weltweit. Beim Menschen kommen vor allem die Genotypen 1 bis 4 der Spezies Orthohepevirus A vor. |
|
Erstmals entdeckt |
|
HEV wurde 1978 nach einem Ausbruch in Indien zum ersten Mal als Nicht-Hepatitis A & Nicht-Hepatitis B-Virus identifiziert (Khuroo et al. 1980). Die fäkal-orale Übertragung wurde erstmals 1983 in einem Selbstversuch beschrieben (Balayan et al. 1983). |
|
Wo kommt der Erreger vor? |
|
Der Erreger kommt weltweit vor. Die Mensch-assoziierten Genotypen 1 und 2 sind in Afrika und Asien verbreitet. Die Genotypen 3 und 4 kommen sowohl bei Menschen als auch bei Tieren (Schwein, Wildschwein, Kaninchen, Rehwild u.a.) vor. Das Verbreitungsgebiet des Genotyps 3 ist Europa und Nordamerika. Genotyp 4 ist vor allem in Asien, insbesondere in China, zu finden. |
|
Betroffene Tierspezies, Reservoir |
|
HEV-ähnliche Viren wurden auch in Vögeln (Spezies Orthohepevirus B), Nagern und Carnivoren (Spezies Orthohepevirus C), Fledermäusen (Spezies Orthohepevirus D) sowie in Fischen (Genus Piscihepevirus) nachgewiesen. Für die zoonotischen Genotypen 3 und 4 stellen Schweine und Wildschweine das Hauptreservoir dar. Es wurde zudem eine Übertragung von Kaninchen-, Dromedar- und Ratten-assoziierten HEV auf Menschen beschrieben. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
In Europa stecken sich Menschen hauptsächlich über den Verzehr unzureichend erhitzter Fleischprodukte von Schwein und Wildschwein an. Daneben gibt es eine steigende Zahl an Infektionen über Bluttransfusionen. In Asien und Afrika erfolgt die Infektion in der Regel über kontaminiertes, fäkal verunreinigtes Trinkwasser. Immunsuppression und Vorschädigung der Leber erhöhen das Risiko für chronische Infektionen und fulminante Verläufe. Einem besonderen Risiko sind Schwangere ausgesetzt, bei denen es nach Infektion mit dem Genotyp 1 zu einem Anstieg der Mortalitätsrate auf 25-30% kommen kann (Aggarwal et al., 2007). |
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
In der Regel sind Infektionen mit HEV asymptomatisch und heilen folgenlos aus. Bei einer symptomatischen akuten Hepatitis treten zunächst unspezifische Krankheitszeichen wie Schwäche, Arthralgien, Myalgien oder Erbrechen auf. Im weiteren Verlauf zeigen sich Hepatitis-typische Symptome wie Ikterus, Pruritus, entfärbter Stuhl und dunkler Urin. In schweren Fällen kann es zu einem schweren Leberversagen kommen. Chronische Verläufe treten vor allem bei Immunsupprimierten meist nach Organtransplantationen auf. Zusätzlich werden extrahepatische Manifestationen beschrieben, z. B. das Gullain-Barre-Syndrom, Glomerulonephritis, Kryoglobulinämie sowie sporadische Fälle von Enzephalitis und Myopathie. Bei den meisten Tieren ist eine Infektion symptomlos. Eine Ausnahme stellt aviäres HEV dar, das beim Geflügel zur Vergrößerung der Milz (Splenomegalie) und Leber (Big Liver and Spleen Disease) und einer Verringerung der Eilegerate führen kann. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Chronische und akute Infektionen lassen sich in der Regel gut mit Ribavirin behandeln. Diese Behandlung ist jedoch für Schwangere kontraindiziert. Zudem wird bei chronisch infizierten Patienten eine zunehmende Zahl von Ribavirin-resistenten Virusvarianten beobachtet. Andere Substanzen wie pegyliertes Interferon oder Sofosbuvir – ein Inhibitor von Hepatitis C-Viren - haben nur begrenzte Wirksamkeit oder müssen noch in klinischen Studien auf ihre Wirksamkeit hin getestet werden. Zurzeit wird an verschiedenen Impfstoffkandidaten gearbeitet. Ein kommerzieller Impfstoff (Hecolin®), dessen Basis ein rekombinantes Kapsid-Protein des HEV ist, wurde bereits im Menschen getestet, er ist allerdings bislang nur in China zugelassen. Ein Grund liegt darin, dass dessen Wirksamkeit bislang nur gegenüber den Genotypen 1 und 4 gezeigt wurde. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Die HEV-Infektion wurde 2001 als meldepflichtige Erkrankung in Deutschland in das Infektionsschutzgesetz (IfSG) aufgenommen. In den letzten Jahren stiegen die in Deutschland gemeldeten HEV-Fälle jedoch deutlich an von 53 in 2004 bis über 3000 Fälle in 2019. Die starke Zunahme lässt sich u.a. durch eine erhöhte Aufmerksamkeit durch behandelnde Ärzte zurückführen. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Neuere Studien deuten darauf hin, dass HEV in zwei Formen existiert: als unbehülltes Virion, das über den Kot ausgeschieden wird, und als ein membranumhülltes („quasi-enveloped“) Virion, das im Blut zirkuliert. Beide Virustypen sind infektiös, unterscheiden sich aber in der Art und Weise, wie sie Zellen infizieren. Bislang ist aber nicht bekannt über welchen Zellrezeptor das Virus-Attachment erfolgt. Auch über die Rolle des viruseigenen ORF3-Proteins gibt es nur wenige Erkenntnisse. Man weiß seit kurzem, dass es als Ionenkanal (Viroporin) für die Virusfreisetzung eine wichtige Rolle spielt. Eine aktuelle Fragestellung ist außerdem die Suche nach Ursachen für die schweren Verläufe und hohe Mortalität bei Schwangeren, die nur durch den Genotypen 1 ausgelöst werden. Weiterhin sind die speziellen Bedingungen zur Herstellung sicherer Lebensmittel aus Schweineprodukten Gegenstand aktueller Forschungen. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Zunächst einmal stehen präventive Maßnahmen durch verbesserte Hygienebedingungen in betroffenen Regionen im Fokus. Für die Ausbreitung der Genotypen 1 und 2 in Asien und Afrika mit verheerenden Ausbrüchen sind die Versorgung mit sauberen Trinkwasser und die Verbesserung der sanitären Hygiene von zentraler Bedeutung. Da in westlichen Ländern in der Regel zoonotische Übertragungen auftreten, sollte vor allem bei bestehender Immunsuppression auf die ausreichende Erhitzung von Fleischprodukten geachtet werden. Zudem werden zurzeit verschiedene neue Wirkstoffe zur Behandlung von HEV getestet. Ein vielversprechender Kandidat ist dabei Silvestrol, ein Naturstoff, der aus Mahagonigewächsen extrahiert wird. Die antivirale Wirkung konnte bereits in vitro in HEV-infizierten menschlichen Leberzellen und in vivo mit humanisierten Mäusen erfolgreich nachgewiesen werden. |
|
Wo liegen zukünftige Herausforderungen? |
|
Nach wie vor fehlt ein von der WHO zugelassener und geprüfter Impfstoff, dessen Wirksamkeit für alle humanpathogenen Genotypen und für alle Altersgruppen nachgewiesen wurde. Gerade im Hinblick auf die weltweiten Flüchtlingsströme und teils prekären hygienischen Bedingungen in Flüchtlingslagern, die großer HEV-Ausbrüche zur Folge haben können (z.B. in Uganda und Sudan), ist die Entwicklung und Bereitstellung eines Impfstoffs von zentraler Bedeutung. |
Für die fachliche Unterstützung bei der Erstellung des HEV-Steckbriefes danken wir Dr. Martin Eiden (Friedrich-Loeffler-Institut) und Prof. Dr. Reimar Johne (BfR, Berlin).
In Deinen Augen fehlt noch ein wichtiger Erreger in unserer Liste? Du hast noch einen Expertenvorschlag für uns? Bitte schreibt uns Eure Anregungen und Wünsche gerne an zoonosenplattform@fli.de Stichwort "Zoonose des Monats".
Wir freuen uns auf Eure Vorschläge.