Persistenz von Toxoplasma gondii Infektionen: Wirkmechanismen von potentiellen Medikamentenkandidaten und die Rolle der physiologische Heterogenität
Hintergrund
Toxoplasma gondii ist ein apicomplexer Parasit, der praktisch alle Warmblüter und weltweit 30% der Menschen infiziert. In Deutschland führt eine Serokonvertierungsrate von 1% pro Jahr zu einer Prävalenz von 50%. Dies illustriert die Notwendigkeit die zoonotische Übertragung der Parasiten im Interesse der öffentlichen Gesundheit zu reduzieren. T. gondii Infektionen sind typischer Weise selbst limitierend, jedoch können während kongenitaler Übertragung und in immunkompromitierten Personen schwere und fatale Symptome auftreten. Im Vergleich mit anderen nahrungsmittelübertragenen Infektionskrankheiten verursacht T. gondii eine der höchsten Krankheitslasten. Ansteckungen finden u.a. durch chronisch persistierende Gewebszysten in ungaren Fleischprodukten statt. Im Gegensatz zu akuten Formen des Parasiten adoptieren die Dauerstadien , sog. Bradyzoiten sehr heterogene Erscheinungsformen und widerstehen allen verfügbaren medikamentösen Behandlungen.
Aufgabe
Die Nachwuchsgruppe Toxo beforscht Eigenheiten des Stoffwechsels von Bradyzoiten um evidenzbasierte neuartige Behandlungen zu entwickeln. Die Arbeiten beinhalten einen systematischen Screen antimikrobieller Verbindungen und einen metabolomik-zentrierten Ansatz basierend auf Gas- und Flüssigkeitschromatographie-gekoppelter Massenspektroskopie. Die so angestrebte Identifikation molekularer Zielstrukturen dieser Verbindungen wird die Entwicklung und Optimierung der dringend benötigten Wirkstoffkandidaten erleichtern.
Komplementärer Ansatz
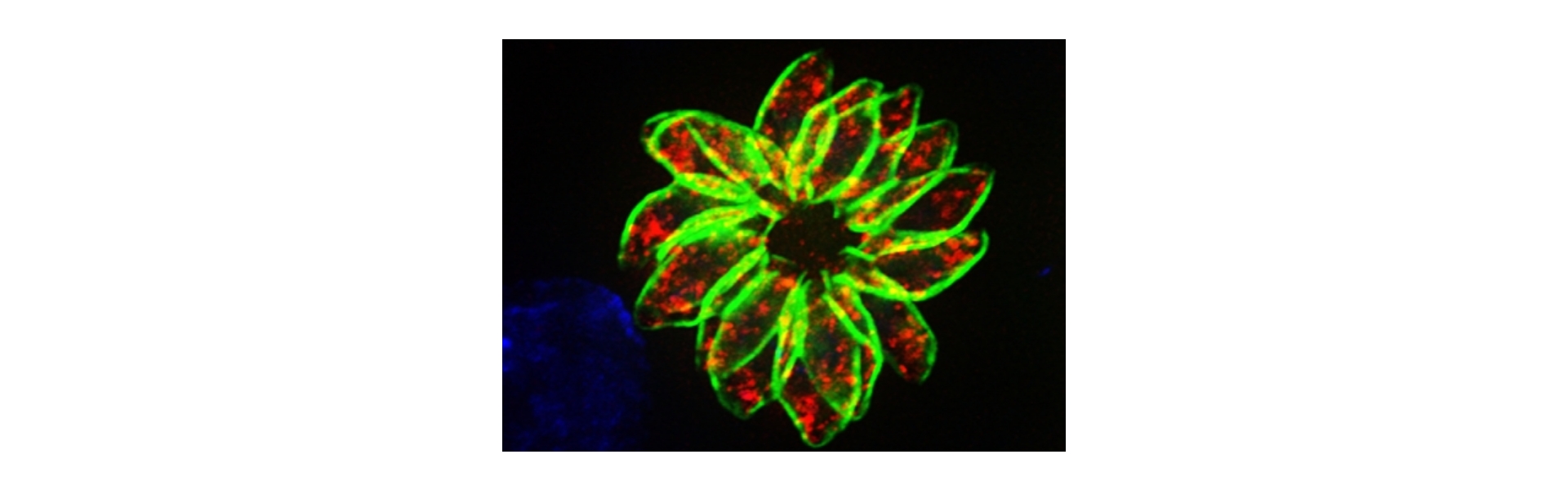
In einem komplementären Ansatz untersucht die Toxo Nachwuchsgruppe die physiologischen Grundlagen persistierender Parasitenpopulationen in verschiedenen veterinären T. gondii-Isolaten. Gewebszysten aus klonalen Parasitenpopulationen sind phänotypisch sehr heterogen. Diese Heterogenität könnte eine Grundlage für die Persistenz und Therapieresistenz sein. Wir generieren fluoreszierende Reporterzelllinien, die uns erlauben die Reaktion individueller Zysten und Parasiten während der Reaktion auf Stressoren wie zum Beispiel verschiedene Inhibitoren zu untersuchen. Diese Daten werden dann für die Kalibrierung eines computergestützten Modells benutzt, dass es uns erlaubt den Beitrag einzelner Subpopulationen zur Persistenz zu quantifizieren.
Zusammenfassend hat die Nachwuchsgruppe Toxo das Ziel, die fürm die zoonotische Übertragung wesentliche Persistenz zu verstehen und daraus Behandlungsansätze abzuleiten.
1. Identifizierung der Wirkungsweise von T.-gondii-Zysteninhibitoren
Es existieren momentan keine Medikamente, die effektiv gegen chronische T.-gondii-Infektionen wirken. Solche latenten Infektionen sind zwar meistens symptomlos, können jedoch in akute Infektionen münden und sind Grundlage für eine hohe Ansteckungsrate, die zu 50% Prävalenz in Deutschland führt.
Es gibt zwei grundlegende Strategien neue Medikamentenkandidaten zu entwickeln. Der klassische pharmakologische Ansatz basiert auf einem initialen phänotypischen Screen um potente Wirkstoffe zu identifizieren. Jedoch ist die Optimierung dieser initialen hits aufgrund der unbekannten Wirkweise oft schwierig. Dem entgegen steht der revers-pharmakologische Ansatz nach dem zuerst essentielle Proteine als potentielle Zielstrukturen charakterisiert werden. Allerdings sind für diese Ziele synthetisierte Inhibitoren auf organismischer Ebene oft ineffizient.
Die Toxo-Nachwuchsgruppe will die Vorteile der beiden Verfahren kombinieren, indem wir eine umfangreiche Metabolomikplattform etablieren, die es erlaubt die parasitäre Stoffwechselantwort auf entsprechende Antimikrobiota umfassend zu charakterisieren und so Zielstrukturen und Wirkweisen zu identifizieren. Diese Plattform besteht aus einem UHPLC-gekoppelten hochauflösendem Orbitrap Massenspektrometer sowie einem Gaschromatographie-gekoppelten Massenspektrometer. Zusammen ermöglichen diese Instrumente den Nachweis hunderter kleiner Stoffwechselmoleküle (Metabolite), die entsprechende Enzymaktivitäten widerspiegeln. Solche zieloffenen Analysen ergeben ein feinkörniges Abbild des Stoffwechselphänotyps, dass es uns erlaubt mögliche Zielstoffwechselwege und Zielenzyme zu identifizieren. Durch nachfolgende gezieltere Ansätze werden diese putativen Zielstrukturen durch Isotopenmarkierungen und revers-genetische Ansätze bestätigt.
Mit dieser auf ungezielter Metabolomik basierenden Strategie hoffen wir neue Behandlungsansätze für chronische Toxoplasma-Infektionen zu finden, die auch auf andere Krankheitserreger übertragbar sind.
2. Quantifizierung des Beitrags der Heterogenität zu chronischen Infektionen von T. gondii
Im Gegensatz zu akute Formen von T. gondii widerstehen persistierende Stadien des Parasiten dem Immunsystem des Wirtes und allen verfügbaren medikamentösen Behandlungen. Diese Dauerstadien proliferieren asynchron und mit stark unterschiedlichen Teilungsraten und Gewebszysten zeigen weiterhin markante Unterschiede in der Packungsdichte und Größe. Die phänotypische Heterogenität klonaler Populationen von Mikroorganismen fungiert für viele Pathogene als Absicherungsmechanismus; für T. gondii ist ihre Funktion allerdings nicht untersucht. Um die Spannweite der Phänotypen auf Einzelzellebene zu messen benutzen wir fluoreszierende Reporterparasiten, die uns erlauben grundlegende physiologisch Parameter wie zum Beispiel die Zellteilungsaktivität, den pH-Wert und Metabolitvorkommen zu messen. Wir verwenden diese physiologischen Daten um Subpopulationen zu definieren und um ein Computermodell zu kalibrieren. Dieses hat zum Ziel die Persistenz und Virulenzphänotypen verschiedener veterinärmedizinischer Isolate auf Grundlage dieser Subpopulationen zu replizieren.
Koordination
Dr. Martin Blume
Nachwuchsgruppe 2
Robert Koch-Institut
Berlin
E-Mail: blumem(at)rki.de
Tel. +49 (0)30 18754 2572
Metabolic determinants of cold tolerance of Aedes Mosquito eggs Ruth Müller, Goethe Universität Frankfurt, Institute of Occupational, Social and Environmental Medicine
Characterization of the metabolic role of Ferredoxin in Toxoplasma gondii Frank Seeber, Robert Koch-Institute, FG16
Characterization of polyunsaturated fatty acid degradation in Leishmania major Toni Aebischer, Robert Koch-Institute, FG16
Metabolomic signature of hanta virus infected cells Rainer Ulrich, Friedrich-Loeffler-Institute